题目内容
9.已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ/mol.现有SO2和O2各2mol,在恒温下的固定体积容器中反应,平衡时SO2的转化率为a,而在绝热密闭的同一反应容器中反应,平衡时SO2的转化率为b,则a与b的正确关系为( )| A. | a>b | B. | a=b | C. | a<b | D. | 无法判断 |
分析 在恒温下的固定体积容器中反应,随反应进行气体物质的量减小压强减小的过程,在绝热密闭的同一反应容器中反应,反应是放热反应,温度升高平衡逆向进行,据此分析判断二氧化硫的转化率.
解答 解:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ/mol,反应是气体体积减小的放热反应,恒温下的固定体积容器中反应,平衡时SO2的转化率为a,在绝热密闭的同一反应容器中反应,由于温度升高平衡逆向进行,二氧化硫的转化率减小,平衡时SO2的转化率为b<a,
故选A.
点评 本题考查了化学平衡影响因素的分析判断,注意恒温恒容容器和恒容绝热容器的不同,题目较简单.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
11.我国在全球最先发现天然金属铀.下列对铀元素的一种核素的说法正确的是( )
| A. | 核电荷数为92 | B. | 质子数为143 | C. | 中子数为235 | D. | 核外电子数为235 |
12.下列说法正确的是( )
| A. | 有机化合物中只存在极性键 | |
| B. | 碳原子最外层有4个电子,在形成化合物时必须与4个原子结合 | |
| C. | 碳原子间可形成非极性键 | |
| D. | 碳原子易失去或获得电子而形成阳离子或阴离子 |
17.阿伏加德罗曾做过这样一个实验:一个抽空的密闭容器重Mg,在标准状况下,盛满CH4气体,称量为(M+Q)g,把CH4气体排尽,再充入SO2气体,称得的质量为( )
| A. | M+2Q | B. | M+4Q | C. | 2Q | D. | 2M+2Q |
14.醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:
i.2CH3OH(g)?CH3OCH3(g)+H2O(g)
ii.2CH3OH(g)?C2H4(g)+H2O(g)
I.上述反应过程中能量变化如图所示:
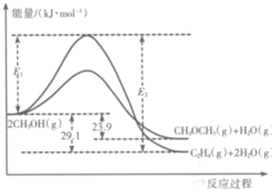
(1)在某密闭容器中,充人一定量CH3OH(g)发生上述两个反应,反应ⅰ(填“i”或“ii”)的速率较大,其原因为该反应的活化能较小.若在容器中加入催化剂,使ii的反应速率增大,则E1和E2-E1的变化是:
E1减小;E2-E1不变(填“增大”、“减小”或“不变”).
(2)已知:CH3CH2OH(g)=CH3OCH3(g)△H=+50.7kJ.mol-1.则乙烯气相直接水合反应C2H4(g)+H2O(g)=C2H5OH(g)的△H=-45.5 kJ•mol-1.
Ⅱ,某研究小组通过控制反应条件,在三个容积均为2L的密闭容器中只发生反应i,起始反应温度均为T℃,起始投料如下表所示:
(3)比较平衡时容器1中c1(H2O)和容器2中c2(H2O)的大小:c1(H2O)<c2(H2O)(填“>”、“<”或“=”);三个容器中反应的化学平衡常数分别记为K1、K2和K3,三者的大小关系为K1=K2>K3.
(4)若容器1中平衡时CH3OH(g)的转化率为80%,则该温度下反应i的平衡常数K=4.
i.2CH3OH(g)?CH3OCH3(g)+H2O(g)
ii.2CH3OH(g)?C2H4(g)+H2O(g)
I.上述反应过程中能量变化如图所示:

(1)在某密闭容器中,充人一定量CH3OH(g)发生上述两个反应,反应ⅰ(填“i”或“ii”)的速率较大,其原因为该反应的活化能较小.若在容器中加入催化剂,使ii的反应速率增大,则E1和E2-E1的变化是:
E1减小;E2-E1不变(填“增大”、“减小”或“不变”).
(2)已知:CH3CH2OH(g)=CH3OCH3(g)△H=+50.7kJ.mol-1.则乙烯气相直接水合反应C2H4(g)+H2O(g)=C2H5OH(g)的△H=-45.5 kJ•mol-1.
Ⅱ,某研究小组通过控制反应条件,在三个容积均为2L的密闭容器中只发生反应i,起始反应温度均为T℃,起始投料如下表所示:
起始投料/mol 编号 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| 恒温容器1 | 2 | 0 | 0 |
| 恒温容器2 | 0 | 2 | 2 |
| 绝热容器3 | 2 | 0 | 0 |
(4)若容器1中平衡时CH3OH(g)的转化率为80%,则该温度下反应i的平衡常数K=4.
1.下列关于物质或离子检验的叙述正确的是( )
| A. | 在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+ | |
| B. | 气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气 | |
| C. | 灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+ | |
| D. | 在溶液中加稀盐酸,无现象,继续加入BaCl2溶液产生白色沉淀,证明原溶液有SO42- |
18.某矿石由前20号元素中的四种组成,其化学式为WYZX4.X、Y、Z、W分布在三个周期,原子序数依次增大,Y、W为金属元素,X原子的最外层电子数是次外层电子数的3倍,W能与冷水剧烈反应,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等,Y、Z位于同一周期,Z单质是一种良好的半导体.则下列判断不正确的是( )
| A. | 原子半径:W>Y>Z>X | |
| B. | 气态氢化物的稳定性:Z<X | |
| C. | Y、Z的氧化物都有两性 | |
| D. | Y、W最高价氧化物对应水化物间可以相互反应 |
 到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.