题目内容
下列关于溶液物质的量浓度的说法正确的是( )
| A、把1molNaCl溶于1L水中所得溶液的物质的量浓度为1mol/L |
| B、实验室配制500mL 0.1mol/L的CuSO4溶液,需称取胆矾12.5g |
| C、1L水中溶解224 L HCl气体(标准状况下测得)后形成溶液物质的量浓度为10 mol?L1 |
| D、将7.4克氢氧化钙放入烧杯中,加水搅拌冷却后全部转移到100 mL容量瓶并加水至刻度线,浓度为1 mol?L-1 |
考点:物质的量浓度的相关计算
专题:
分析:A.应是溶液体积为1L,不是溶剂水的体积为1L;
B.根据n=cV计算硫酸铜的物质的量,再根据m=nM计算需要胆矾的质量;
C.标况下224L HCl的物质的量为10mol,溶于水配成1L溶液,所得溶液浓度为10mol/L;
D.7.4g氢氧化钙的物质的量为0.1mol,氢氧化钙属于微溶,100g水不能溶解7.4g氢氧化钙.
B.根据n=cV计算硫酸铜的物质的量,再根据m=nM计算需要胆矾的质量;
C.标况下224L HCl的物质的量为10mol,溶于水配成1L溶液,所得溶液浓度为10mol/L;
D.7.4g氢氧化钙的物质的量为0.1mol,氢氧化钙属于微溶,100g水不能溶解7.4g氢氧化钙.
解答:
解:A.把1molNaCl溶于水,配成1L溶液,所得溶液的物质的量浓度为1mol/L,溶液体积为1L,不是溶剂水的体积为1L,故A错误;
B.硫酸铜的物质的量为0.5L×0.1mol/L=0.05mol,胆矾物质的量等于硫酸铜物质的量,需要胆矾的质量为0.05mol×250g/mol=12.5g,故B正确;
C.标况下224L HCl的物质的量为10mol,溶于水配成1L溶液,所得溶液浓度为10mol/L,故C错误;
D.7.4g氢氧化钙的物质的量为0.1mol,若完全溶解所得溶液浓度为1mol/L,但氢氧化钙属于微溶,100g水不能溶解7.4g氢氧化钙,故D错误,
故选B.
B.硫酸铜的物质的量为0.5L×0.1mol/L=0.05mol,胆矾物质的量等于硫酸铜物质的量,需要胆矾的质量为0.05mol×250g/mol=12.5g,故B正确;
C.标况下224L HCl的物质的量为10mol,溶于水配成1L溶液,所得溶液浓度为10mol/L,故C错误;
D.7.4g氢氧化钙的物质的量为0.1mol,若完全溶解所得溶液浓度为1mol/L,但氢氧化钙属于微溶,100g水不能溶解7.4g氢氧化钙,故D错误,
故选B.
点评:本题考查物质的量浓度有关计算,难度不大,注意对公式的理解与灵活应用,D选项为易错点,学生容易忽略溶解度问题.

练习册系列答案
相关题目
在室温下,下列叙述正确的是( )
| A、将1mLpH=3的一元酸溶液稀释到10mL,若溶液的pH<4,则此酸为弱酸 |
| B、将1mL1.0×10-5mol/L盐酸稀释到1000mL,溶液的pH=8 |
| C、用pH=1的盐酸分别中和1mLpH=13NaOH溶液和氨水,NaOH消耗盐酸的体积大 |
| D、ph=2的盐酸与pH=1的硫酸比较,c(Cl-)=c(SO42-) |
已知M、W、X、Y、Z为短周期元素,M为形成化合物最多的元素,W、Z同主族,X、Y、Z同周期,Z元素的原子序数为W的2倍,Z的最外层电子数为Y的最外层电子数的2倍,Y的电子层数和最外层电子数相等,W和X能形成X2W和X2W2两种常见化合物,下列说法错误的是( )
| A、W、X、Y形成的简单离子半径大小关系为W>X>Y |
| B、M、W元素形成的简单氢化物的沸点:W>M |
| C、X金属元素是同周期中金属性最强的元素 |
| D、Z的最高价氧化物对应的水化物的浓溶液能与Y在常温下剧烈反应 |
下列各组物质的稀溶液相互反应,把前者逐滴滴入后者与把后者逐滴滴入前者,所产生的现象相同的是( )
| A、AlCl3 和NaOH |
| B、Na2CO3和HCl |
| C、NaHCO3和HCl |
| D、NaAlO2和HCl |
下列热化学方程式中的反应热表示燃烧热的是( )
| A、C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l);△H=-akJ?mol-1 | ||||
B、CH3CH2OH(l)+
| ||||
C、C(s)+
| ||||
D、NH3(g)+
|
混合气体由N2和CH4组成,测得混合气体在标准状况下的密度为0.821g/L,则混合气体中N2和CH4的体积之比为( )
| A、5:1 | B、1:4 |
| C、4:1 | D、1:5 |
下列有关化学用语表示正确的是( )
A、氯离子的结构示意图: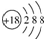 | ||
| B、明矾的化学式:KAl(SO4)2 | ||
C、中子数为10的氧原子:
| ||
D、溴化铵的电子式: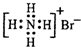 |
