题目内容
已知A、B、C、D四元素的核电荷数依次增加,它们的离子的电子层数相同且最外层电子数均为8.A原子的L层电子数与K、M层电子数之和相等,D原子的K、L层电子数之和等于电子总数的一半.完成以下问题:
(1)写元素符号A: ;B: ;C: ;D: .它们原子半径由大到小的顺序是 .
(2)写对应元素的离子结构示意图A: ;B: .A、B、C、D四种离子的半径由大到小的顺序为 .
(3)写出最高价氧化物对应水化物化学式:B 、C .
(4)写出A、B气态氢化物稳定性由大到小顺序(用氢化物化学式表示): ,理由是 .
(1)写元素符号A:
(2)写对应元素的离子结构示意图A:
(3)写出最高价氧化物对应水化物化学式:B
(4)写出A、B气态氢化物稳定性由大到小顺序(用氢化物化学式表示):
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D 4种元素的核电荷数依次增大,A原子的L层电子数与K、M层电子数之和相等,则M层电子数=8-2=6,故A为S元素;D原子的K、L层电子数之和等于电子总数的一半,则L层已经排满电子,故核外电子数=2×(2+8)=20,故D为Ca元素,四元素的离子的电子层数相同且最外层电子数均为8,结合原子序数,可推知,B为Cl、C为K,据此解答.
解答:
解:A、B、C、D 4种元素的核电荷数依次增大,A原子的L层电子数与K、M层电子数之和相等,则M层电子数=8-2=6,故A为S元素;D原子的K、L层电子数之和等于电子总数的一半,则L层已经排满电子,故核外电子数=2×(2+8)=20,故D为Ca元素,四元素的离子的电子层数相同且最外层电子数均为8,结合原子序数,可推知,B为Cl、C为K,
(1)由上述分析可知,A为S,B为Cl,C为K,D为Ca,根据电子层数越多,原子半径越大,电子层数相同,核电荷数越大,离子半径越小,可知它们的半径由大到小的顺序是K>Ca>S>Cl,故答案为:S;Cl;K;Ca;K>Ca>S>Cl;
(2)硫离子的结构示意图为 ,氯离子的结构示意图为
,氯离子的结构示意图为 ,电子层结构相同,核电荷数越大,离子半径越小,故离子半径r(S2-)>r(Cl-)>r(K+)>r(Ca2+),
,电子层结构相同,核电荷数越大,离子半径越小,故离子半径r(S2-)>r(Cl-)>r(K+)>r(Ca2+),
故答案为: ;
; ;r(S2-)>r(Cl-)>r(K+)>r(Ca2+);
;r(S2-)>r(Cl-)>r(K+)>r(Ca2+);
(3)B为氯元素,C为钾元素,它们最高价氧化物对应水化物化学式分别为HClO4和KOH,故答案为:HClO4;KOH;
(4)氯元素的非金属性强于硫元素,故氢化物稳定性HCl>H2S,故答案为:HCl>H2S;氯元素的非金属性强于硫元素.
(1)由上述分析可知,A为S,B为Cl,C为K,D为Ca,根据电子层数越多,原子半径越大,电子层数相同,核电荷数越大,离子半径越小,可知它们的半径由大到小的顺序是K>Ca>S>Cl,故答案为:S;Cl;K;Ca;K>Ca>S>Cl;
(2)硫离子的结构示意图为
 ,氯离子的结构示意图为
,氯离子的结构示意图为 ,电子层结构相同,核电荷数越大,离子半径越小,故离子半径r(S2-)>r(Cl-)>r(K+)>r(Ca2+),
,电子层结构相同,核电荷数越大,离子半径越小,故离子半径r(S2-)>r(Cl-)>r(K+)>r(Ca2+),故答案为:
 ;
; ;r(S2-)>r(Cl-)>r(K+)>r(Ca2+);
;r(S2-)>r(Cl-)>r(K+)>r(Ca2+);(3)B为氯元素,C为钾元素,它们最高价氧化物对应水化物化学式分别为HClO4和KOH,故答案为:HClO4;KOH;
(4)氯元素的非金属性强于硫元素,故氢化物稳定性HCl>H2S,故答案为:HCl>H2S;氯元素的非金属性强于硫元素.
点评:本题考查结构性质位置关系应用,充分根据核外电子排布推断A、D,注意掌握微粒半径比较规律,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
已知:将Cl2通入适量KOH溶液,产物中可能有KC1、KClO、KClO3,且
的值与温度高低有关.当n(KOH)=a mol时,下列有关说法错误的是( )
| c(Cl-) |
| c(ClO-) |
A、参加反应的氯气的物质的量等于
| ||||||||
B、若某温度下,反应后
| ||||||||
C、改变温度,产物中KC1O3的最大理论产量为
| ||||||||
D、改变温度,反应中转移电子的物质的量ne的范围:
|
关于CH4和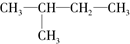 的叙述正确的是( )
的叙述正确的是( )
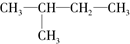 的叙述正确的是( )
的叙述正确的是( )| A、均能用CnH2n+2组成来表示 |
| B、与所有烷烃互为同素异形体 |
| C、因为它们结构相似,所以它们的化学性质相似,但物理性质不相同 |
| D、通常状况下它们都是气态烷烃 |
下列各对物质中属于同分异构体的是( )
| A、12C和13C |
| B、O2和O3 |
| C、丁烷和戊烷 |
| D、丁烷和2-甲基丙烷 |
下列说法不正确的是( )
| A、“白色污染”主要是由合成材料的废弃物,特别是一些塑料制品废弃物造成的 |
| B、“白色污染”只能影响环境卫生,没有其他危害 |
| C、治理“白色污染”主要应从减少使用、加强回收和再利用开始 |
| D、使用可降解塑料是治理“白色污染”的理想方法 |
下列实验现象的描述正确的是( )
| A、氢气在氯气中燃烧,发出苍白色火焰,瓶口上方有白色烟雾 |
| B、氧化铁溶于水生成红褐色沉淀 |
| C、铜在氯气中燃烧,产生棕黄色烟 |
| D、钠在空气中燃烧,发出黄色的火焰,生成白色固体 |
下列关于 0.2mol/L 硝酸钾溶液的叙述中,正确的是( )
| A、1L 该溶液中含硝酸钾 202g |
| B、100mL 该溶液中含硝酸钾0.02mol |
| C、从 1L该溶液中取出500 mL 后,剩余溶液的浓度为0.1mol/L |
| D、1L水中溶解0.2mol硝酸钾,即可配得 0.2mol/L硝酸钾溶液 |
NA代表阿伏加德罗常数.下列有关叙述正确的是( )
| A、常温常压下,22.4LCO2中含有NA个CO2分子 |
| B、室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA |
| C、标准状况下,11.2L氦气中约含有NA个氦原子 |
| D、1L0.1mol?L-1Na2SO3溶液中含有0.1NA个SO32- |