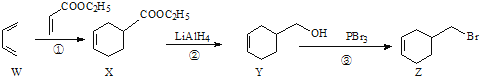
题目内容
【题目】某实验室把学生做完实验后的废液(含氯化钠、氯化铁、氯化铜等)进行集中处理,过程如下:

(1)沉淀D的化学式为_________________。
(2)反应③中Cl2属于_______________(填“氧化剂”或“还原剂”)。
(3)写出①反应中的离子方程式________________________,___________________________。
(4)溶液C中的溶质是_______________(提示:加热后,溶液中没有了HCl和Cl2),若要进一步进行分离,方法是____________________。
(5)萃取实验所用到的玻璃仪器:_______________、____________________。
【答案】 Cu 氧化剂 2Fe+Fe3+═3Fe2+ Fe+Cu2+═Fe2++Cu NaCl和FeCl3 方法是先加适量NaOH溶液,然后过滤,再在过滤后的沉淀里加适量盐酸 分液漏斗 烧杯
【解析】试题分析:(1)向废液(含氯化钠、氯化铁、氯化铜等)中加入过量的铁,铁和氯化铁反应生成氯化亚铁,铁和氯化铜反应,把铜还原出来,过滤得到铜、铁,再向固体中加入过量的盐酸,可以把铁除去.这时的固体中只含有铜;
(2)滤液A为氯化亚铁和氯化钠,加入过量氯水,氯化亚铁和氯气发生氧化还原反应,氯气为氧化剂;
(3)①中发生铁和氯化铁反应、铁和氯化铜反应,据此分析解答;
(4)滤液A为氯化亚铁和氯化钠,②加入过量的盐酸,反应后滤液为氯化亚铁,加入过量氯水,生成氯化铁,加热后,溶液中没有了HCl和Cl2,所以溶液C中的溶质是氯化钠和氯化铁,分离氯化铁和氯化钠,根据两者的性质差异进行分离;
(5)萃取、分液要用分液漏斗分液、烧杯;
解析:(1)向废液(含氯化钠、氯化铁、氯化铜等)中加入过量的铁,铁和氯化铁反应Fe+2FeCl3═3FeCl2,铁和氯化铜反应,Fe+CuCl2=Cu+FeCl2,将铜完全置换出来后还有铁剩余,故B是铁和铜的混合物,加入过量盐酸,铁与盐酸反应Fe+2HCl=FeCl2+H2↑,过滤,沉淀D只含有铜;
(2)滤液A为氯化亚铁和氯化钠,②加入过量的盐酸,反应后滤液为氯化亚铁,两种滤液中共含有氯化亚铁和氯化钠两种溶质,加入过量氯水,Cl2的氧化性比Fe3+的氧化性强,Cl2能氧化Fe2+,即2FeCl2+Cl2=2FeCl3,氯气中氯元素化合价降低,氯气为氧化剂;
(3))铁具有还原性,氯化铁具有氧化性,①中发生铁和氯化铁反应Fe+2FeCl3═3FeCl2,离子反应为2Fe+Fe3+═3Fe2+,在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,铁排在铜的前面,铁和氯化铜反应,Fe+CuCl2=Cu+FeCl2,离子反应为:Fe+Cu2+═Fe2++Cu;
(4)滤液A为氯化亚铁和氯化钠,②加入过量的盐酸,反应后滤液为氯化亚铁,加入过量氯水,生成氯化铁,加热后,溶液中没有了HCl和Cl2,所以溶液C中的溶质是氯化钠和氯化铁,若要进一步进行分离,先加适量NaOH溶液,氯化铁溶液和氢氧化钠混合反应生成氢氧化铁沉淀和氯化钠,反应的化学方程式为:3NaOH+FeCl3═Fe(OH)3↓+3NaCl,然后过滤,滤液为氯化钠,再在过滤后的沉淀里加适量盐酸3HCl+Fe(OH)3═FeCl3+3H2O,溶液中溶质为氯化铁。
(5)萃取实验所用到的玻璃仪器分液漏斗、 烧杯。

 小学期末标准试卷系列答案
小学期末标准试卷系列答案【题目】根据下列实验现象,所得结论正确的是( )
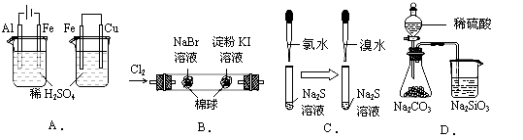
实验 | 实验现象 | 结论 |
A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 活动性:Al>Fe>Cu |
B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>Ⅰ2 |
C | 左边溶液产生黄色沉淀,右边溶液产生黄色沉淀 | 氧化性:Cl2>Br2>S |
D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:S>C>Si |