题目内容
【题目】聚甲基丙烯酸羟乙酯的结构简式为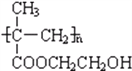 ,它是制作软质隐形眼镜的材料.请写出下列有关反应的化学方程式:
,它是制作软质隐形眼镜的材料.请写出下列有关反应的化学方程式:
(1)由甲基丙烯酸羟乙酯制备聚甲基丙烯酸羟乙酯_________________________;
(2)由甲基丙烯酸制备甲基丙烯酸羟乙酯_________________________;
(3)由乙烯制备乙二醇__________________________________________________;
【答案】 nCH2=C(CH3)COOCH2CH2OH![]()
 CH2=C(CH3)COOH+HOCH2CH2OH
CH2=C(CH3)COOH+HOCH2CH2OH![]() CH2=C(CH3)COOCH2CH2OH+H2O CH2=CH2+Br2→CH2Br-CH2Br、CH2Br-CH2Br+2NaOH
CH2=C(CH3)COOCH2CH2OH+H2O CH2=CH2+Br2→CH2Br-CH2Br、CH2Br-CH2Br+2NaOH![]() HOCH2CH2OH+2NaBr
HOCH2CH2OH+2NaBr
【解析】试题分析:(1)含有碳碳双键,发生加聚反应生成高分子化合物,其反应方程式为nCH2=C(CH3)COOCH2CH2OH![]()
 ;(2)此产物是甲基丙烯酸和乙二醇发生酯化反应得到的,CH2=C(CH3)COOH+HOCH2CH2OH
;(2)此产物是甲基丙烯酸和乙二醇发生酯化反应得到的,CH2=C(CH3)COOH+HOCH2CH2OH![]() CH2=C(CH3)COOCH2CH2OH+H2O;(3)乙烯制备乙二醇,引入两个羟基,是由乙烯先生成两个卤代烃原子,然后卤代烃原子在碱性条件下发生水解,因此合成路线是CH2=CH2+Br2→CH2BrCH2Br,CH2BrCH2Br+2OH-
CH2=C(CH3)COOCH2CH2OH+H2O;(3)乙烯制备乙二醇,引入两个羟基,是由乙烯先生成两个卤代烃原子,然后卤代烃原子在碱性条件下发生水解,因此合成路线是CH2=CH2+Br2→CH2BrCH2Br,CH2BrCH2Br+2OH-![]() HOCH2CH2OH+2Br-。
HOCH2CH2OH+2Br-。

【题目】某实验小组用0.50molL﹣1NaOH溶液和0.50molL﹣1硫酸进行中和热的测定.
(1)Ⅰ.配制0.50molL﹣1NaOH溶液
①配制0.50molL﹣1NaOH溶液时,需要使用的玻璃仪器除量筒、烧杯、玻璃棒外,还有 .
②若实验中约需要240ml0.50molL﹣1NaOH溶液,则应用量筒量取2.5molL﹣1NaOH溶液的体积为 .
(2)Ⅱ.测定中和热
取60mL NaOH溶液和40mL硫酸溶液进行实验,实验数据如表.
实验 | 起始温度t1/℃ | 终止温度 | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.3 | 26.0 | 26.1 | 30.1 |
2 | 27.0 | 27.3 | 27.2 | 33.3 |
3 | 25.9 | 25.9 | 25.9 | 29.8 |
4 | 26.5 | 26.2 | 26.3 | 30.4 |
① 近似认为0.50molL﹣1NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3 , 反应后溶液的比热容为4.18J/(g℃),则中和热△H= . (结果保留一位小数)
② 上述实验数值结果与57.3kJmol﹣1有偏差,产生此偏差的原因可能(填字母).
a.实验装置保温、隔热效果差
b.量取40mL0.50molL﹣1硫酸时俯视读数
c.硫酸倒入小烧杯时,有少量硫酸溅出
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
③ 现将一定量的稀氢氧化钠溶液、稀氢氧化钡溶液、稀氨水分别和1L 0.50mol/L的稀硫酸恰好完全反应,其反应热分别为△H1、△H2、△H3 , 则△H1、△H2、△H3由大到小的关系为 .