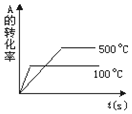
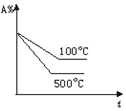
题目内容
17. 已知:25℃时Ksp(BaSO4)=1.0×10-10.该温度下,CaSO4悬浊液中,c(Ca2+)与c(SO42-)的关系如图所示,下列叙述正确的是( )
已知:25℃时Ksp(BaSO4)=1.0×10-10.该温度下,CaSO4悬浊液中,c(Ca2+)与c(SO42-)的关系如图所示,下列叙述正确的是( )| A. | 向a点的溶液中加入等物质的量固体Na2SO4或Ca(NO3)2,析出的沉淀量不同 | |
| B. | a、b、c、d四点对应的体系中,d点体系最稳定 | |
| C. | 升高温度后,溶液可能会由a点转化为b点 | |
| D. | 反应Ba2+(aq)+CaSO4(s)?BaSO4(s)+Ca2+(aq)的平衡常数K=9×104 |
分析 A.向a点的溶液中加入等物质的量固体Na2SO4或Ca(NO3)2,抑制固体溶解的作用相同;
B.曲线上的点为平衡点,c为不饱和溶液,d为过饱和溶液;
C.a点转化为b点,c(Ca2+)减小、c(SO42-)增大,而升高温度,c(Ca2+)与c(SO42-)浓度均增大;
D.反应Ba2+(aq)+CaSO4(s)?BaSO4(s)+Ca2+(aq)的平衡常数K=$\frac{c(C{a}^{2+})}{c(B{a}^{2+})}$=$\frac{Ksp(CaS{O}_{4})}{Ksp(BaS{O}_{4})}$.
解答 解:A.向a点的溶液中加入等物质的量固体Na2SO4或Ca(NO3)2,抑制固体溶解的作用相同,则析出的沉淀量相同,故A错误;
B.曲线上的点为平衡点,c为不饱和溶液,d为过饱和溶液,则d点体系最不稳定,故B错误;
C.a点转化为b点,c(Ca2+)减小、c(SO42-)增大,而升高温度,c(Ca2+)与c(SO42-)浓度均增大,则升高温度不能使溶液由a点转化为b点,故C错误;
D.反应Ba2+(aq)+CaSO4(s)?BaSO4(s)+Ca2+(aq)的平衡常数K=$\frac{c(C{a}^{2+})}{c(B{a}^{2+})}$=$\frac{Ksp(CaS{O}_{4})}{Ksp(BaS{O}_{4})}$=$\frac{9×1{0}^{-6}}{1.0×1{0}^{-10}}$=9×104,故D正确;
故选D.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握Ksp的计算、溶解平衡图象、平衡移动为解答的关键,侧重分析与应用能力的考查,选项D为解答的难点,题目难度不大.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
2.下列叙述错误的是( )
| A. | 胶体化学可用于制备纳米材料 | |
| B. | 钛合金主要用于尖端领域 | |
| C. | 压电陶瓷可实现化学能与电能的转化 | |
| D. | 稀土元素大大改善合金性能被称为冶金工业的维生素 |
9.2011年3月,日本海啸引发福岛第一核电站的放射性物质外泄,有关${\;}_{53}^{131}$I(碘-131)的相关报道成为热门话题.${\;}_{53}^{131}$I是常规核裂变产物之一,可以通过测定${\;}_{53}^{131}$I的含量变化来监测核电站放射性物质的泄漏情况,下列有关${\;}_{53}^{131}$I的叙述中错误的是( )
| A. | ${\;}_{53}^{131}$I的化学性质与${\;}_{53}^{127}$I相同 | |
| B. | ${\;}_{53}^{131}$I的原子序数为53 | |
| C. | ${\;}_{53}^{131}$I的原子核外电子数为78 | |
| D. | ${\;}_{53}^{131}$I的原子核内中子数多于质子数 |
7.下列指定反应的离子方程式正确的是( )
| A. | 用醋酸溶解大理石:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| B. | 向氯化铝溶液中滴加过量氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| C. | 向碳酸氢钙溶液中加入少量烧碱溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+H2O | |
| D. | 亚硫酸钠溶液中滴加酸性高锰酸钾溶液:5SO32-+6H++2MnO4-=5SO42-+2Mn2++3H2O |
 (1)已知如图所示的可逆反应:
(1)已知如图所示的可逆反应: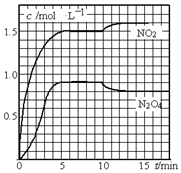 向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应: