题目内容
发射航天火箭常用氮的氢化物肼(N2H4)作燃料.试回答下列有关问题:
(1)写出N2的电子式 ; N2H4的结构式 .
(2)液态NH3类似H2O,也能微弱电离且产生电子数相同的两种离子,则液态NH3电离方程式为 .
(3)25℃时,0.1mol?L-1 NH4NO3溶液中水的电离程度 (填“大于”、“等于“或“小于”).0.1mol?L-l NaOH溶液中水的电离程度.若将0.1mol?L-1 NaOH和0.2mol?L-1 NH4NO3两溶液等体积混合,所得溶液中离子浓度由大到小的顺序为 .
(4)在结构上N2H4和NH3的关系有如H2O2和H2O的关系.N2H4能发生下列反应:
N2H4+H3O+═N2H5++H2O N2H4+H2O?N2H5++OH-
N2H5++H2O?N2H62++OH- N2H5++H2O?N2H4+H3O+
据此可得出的结论是 .
A.肼水解显酸性 B.肼在水中电离出H+离子 C.肼是二元弱碱 D.肼是二元弱酸
(5)完成下列反应方程式并配平:
NH3+ NaClO═ NaCl+ N2H4+
(6)发射火箭时肼(N2H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水.已知4g N2H4(g)在上述反应中放出71kJ的热量,写出该反应的转化学方程式 .
(1)写出N2的电子式
(2)液态NH3类似H2O,也能微弱电离且产生电子数相同的两种离子,则液态NH3电离方程式为
(3)25℃时,0.1mol?L-1 NH4NO3溶液中水的电离程度
(4)在结构上N2H4和NH3的关系有如H2O2和H2O的关系.N2H4能发生下列反应:
N2H4+H3O+═N2H5++H2O N2H4+H2O?N2H5++OH-
N2H5++H2O?N2H62++OH- N2H5++H2O?N2H4+H3O+
据此可得出的结论是
A.肼水解显酸性 B.肼在水中电离出H+离子 C.肼是二元弱碱 D.肼是二元弱酸
(5)完成下列反应方程式并配平:
(6)发射火箭时肼(N2H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水.已知4g N2H4(g)在上述反应中放出71kJ的热量,写出该反应的转化学方程式
考点:电子式,结构式,电离方程式的书写,氧化还原反应方程式的配平,离子浓度大小的比较
专题:化学用语专题,氧化还原反应专题
分析:(1)氮气分子中存在氮氮三键,氮原子最外层为8电子;N2H4中N原子之间形成1对共用电子对,N原子H原子质量形成1对共用电子对;
(2)根据水的电离方程式书写液态NH3电离方程式;
(3)根据硝酸铵溶液中铵离子水解促进了水的电离,氢氧化钠溶液中氢氧根离子抑制了水的电离判断;
由于是等体积混合,反应后的溶液可以看做是0.05mol?L-1NH4NO3、0.05mol?L-1NH3?H2O、0.05mol?L-1NaNO3,然后根据溶液显示碱性判断溶液中各离子浓度大小关系;
(4)依据四个反应的特征,从结合氢离子,结合水中的氢分析判断;
(5)NH3和NaClO反应生成N2H4、NaCl,根据得失电子守恒和原子守恒来配平方程式.
(6)根据n=
计算32gN2H4的物质的量,再根据热化学方程式书写原则书写热化学方程式;
(2)根据水的电离方程式书写液态NH3电离方程式;
(3)根据硝酸铵溶液中铵离子水解促进了水的电离,氢氧化钠溶液中氢氧根离子抑制了水的电离判断;
由于是等体积混合,反应后的溶液可以看做是0.05mol?L-1NH4NO3、0.05mol?L-1NH3?H2O、0.05mol?L-1NaNO3,然后根据溶液显示碱性判断溶液中各离子浓度大小关系;
(4)依据四个反应的特征,从结合氢离子,结合水中的氢分析判断;
(5)NH3和NaClO反应生成N2H4、NaCl,根据得失电子守恒和原子守恒来配平方程式.
(6)根据n=
| m |
| M |
解答:
解:(1)N2,氮气中存在氮氮三键,氮原子最外层达到8电子稳定结构,氮气的电子式为 ,
,
N2H4中N原子之间形成1对共用电子对,N原子H原子质量形成1对共用电子对,结构式为 ;
;
故答案为: ;
; ;
;
(2)液态NH3类似H2O,也能微弱电离且产生电子数相同的两种离子,根据水的电离方程式书写液态NH3电离方程式为:2NH3?NH4++NH2-;
故答案为:2NH3?NH4++NH2-;
(3)硝酸铵溶液中,应用铵离子结合水电离的氢氧根离子,促进了水的电离,而氢氧化钠溶液中氢氧根离子抑制了水的电离,所以硝酸铵溶液中水的电离程度大于氢氧化钠溶液中水的电离程度,
由于是等体积混合,反应后的溶液可以看做是0.05mol?L-1NH4NO3、0.05mol?L-1NH3?H2O、0.05mol?L-1NaNO3,溶液呈碱性,所以溶液中离子浓度关系为:c(NO3-)>c(NH4+)>c(Na+)>c(OH-)>c(H+),
故答案为:大于;c(NO3-)>c(NH4+)>c(Na+)>c(OH-)>c(H+);
(4)A、依据反应N2H4+H3O+═N2H5++H2O 实质是肼结合氢离子反应证明肼具有碱性,故A错误;
B、依据反应N2H4+H2O?N2H5++OH-,N2H5++H2O?N2H62++OH-说明肼结合水中的氢离子发生了电离生成了氢氧根离子,故B错误;
C、肼结合水中的氢离子发生了电离生成了氢氧根离子,溶液显碱性且能发生两步电离,证明肼是二元弱碱,故C正确;
D、肼分子结合水中的氢离子发生了电离生成了氢氧根离子,属于二元碱,故D错误;
故答案为:C;
(5)NH3和NaClO反应生成N2H4、NaCl,NH3中氮由-3价变成-2价,升高1,NaClO中氯由+1价变成-1,降低2,所以NH3和NaClO的计量数2:1,然后根据原子守恒,方程为:2NH3+NaClO=N2H4+NaCl+H2O,
故答案为:2;1;1;1;H2O;
(6)4gN2H4的物质的量为
=
mol,与二氧化氮反应生成氮气与气态水放出71kJkJ的热量,则1mol气体肼完全燃烧生成气态水放出的热量为568kJ,所以该反应的热化学方程式是:2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1136kJ?mol-1,
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+2H2O (g)△H=-1136kJ/mol;
 ,
,N2H4中N原子之间形成1对共用电子对,N原子H原子质量形成1对共用电子对,结构式为
 ;
;故答案为:
 ;
; ;
;(2)液态NH3类似H2O,也能微弱电离且产生电子数相同的两种离子,根据水的电离方程式书写液态NH3电离方程式为:2NH3?NH4++NH2-;
故答案为:2NH3?NH4++NH2-;
(3)硝酸铵溶液中,应用铵离子结合水电离的氢氧根离子,促进了水的电离,而氢氧化钠溶液中氢氧根离子抑制了水的电离,所以硝酸铵溶液中水的电离程度大于氢氧化钠溶液中水的电离程度,
由于是等体积混合,反应后的溶液可以看做是0.05mol?L-1NH4NO3、0.05mol?L-1NH3?H2O、0.05mol?L-1NaNO3,溶液呈碱性,所以溶液中离子浓度关系为:c(NO3-)>c(NH4+)>c(Na+)>c(OH-)>c(H+),
故答案为:大于;c(NO3-)>c(NH4+)>c(Na+)>c(OH-)>c(H+);
(4)A、依据反应N2H4+H3O+═N2H5++H2O 实质是肼结合氢离子反应证明肼具有碱性,故A错误;
B、依据反应N2H4+H2O?N2H5++OH-,N2H5++H2O?N2H62++OH-说明肼结合水中的氢离子发生了电离生成了氢氧根离子,故B错误;
C、肼结合水中的氢离子发生了电离生成了氢氧根离子,溶液显碱性且能发生两步电离,证明肼是二元弱碱,故C正确;
D、肼分子结合水中的氢离子发生了电离生成了氢氧根离子,属于二元碱,故D错误;
故答案为:C;
(5)NH3和NaClO反应生成N2H4、NaCl,NH3中氮由-3价变成-2价,升高1,NaClO中氯由+1价变成-1,降低2,所以NH3和NaClO的计量数2:1,然后根据原子守恒,方程为:2NH3+NaClO=N2H4+NaCl+H2O,
故答案为:2;1;1;1;H2O;
(6)4gN2H4的物质的量为
| 4g |
| 32g/mol |
| 1 |
| 8 |
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+2H2O (g)△H=-1136kJ/mol;
点评:本题主要考查了氮的化合物性质,涉及知识点较多,是一道综合性较大的题目,培养了学生分析问题、解决问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 氯仿(CHCl3)常因保存不慎而被氧化,产生剧毒物光气(COCl2):2CHCl3+O2→2HCl+2COCl2.下列说法不正确的有( )
氯仿(CHCl3)常因保存不慎而被氧化,产生剧毒物光气(COCl2):2CHCl3+O2→2HCl+2COCl2.下列说法不正确的有( )| A、CHCl3分子的空间构型为正四面体 |
| B、COCl2分子中中心C原子采用sp2杂化 |
| C、COCl2分子中所有原子的最外层电子都满足8电子稳定结构 |
| D、使用前可用硝酸银稀溶液检验氯仿是否变质 |
当两个原子形成共价键时,原子的能量将( )
| A、都升高 |
| B、都降低 |
| C、都保持不变 |
| D、一个升高,一个降低 |


 图中X、Y、Z、W是地壳含量前四位(不按顺序)的元素组成的单质,其它为化合物,A有磁性.它们之间存在如下转化关系(部分产物已略去).
图中X、Y、Z、W是地壳含量前四位(不按顺序)的元素组成的单质,其它为化合物,A有磁性.它们之间存在如下转化关系(部分产物已略去).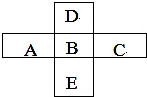 A、B、C、D、E五种主族元素所处周期表的位置如图所示.
A、B、C、D、E五种主族元素所处周期表的位置如图所示.