题目内容
17.下列说法正确的是( )| A. | 向鸡蛋清的溶液中加入浓的硫酸钠溶液或福尔马林,蛋白质的性质发生改变并凝聚 | |
| B. | 将牛油和烧碱溶液混合加热,充分反应后加入热的饱和食盐水,上层析出甘油 | |
| C. | 氨基酸为高分子化合物,种类较多,分子中都含有-COOH和-NH2 | |
| D. | 淀粉、纤维素、麦芽糖在一定条件下可与水作用转化为葡萄糖 |
分析 A.加入硫酸钠,蛋白质不变性;
B.甘油易溶于水;
C.氨基酸为小分子化合物;
D.淀粉、纤维素、麦芽糖分别为多糖、二糖,可水解.
解答 解:A.加入浓硫酸钠溶液,蛋白质发生盐析,不变性,故A错误;
B.甘油易溶于水,上层为高级脂肪酸钠,故B错误;
C.高分子化合物的相对分子质量在10000以上,氨基酸为小分子化合物,故C错误;
D.淀粉、纤维素、麦芽糖分别为多糖、二糖,可水解生成葡萄糖,故D正确.
故选D.
点评 本题多角度考查有机物的组成、结构和性质,为高考常见题型和高频考点,侧重考查学生的分析能力以及双基的掌握,难度不大,注意把握常见有机物的性质.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.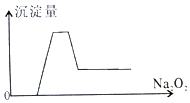 有一透明溶液,取出少量滴入BaCl2溶液,有白色沉淀生成;另取一定体积的该溶液加入过量Na2O2,有无色有刺激性味气体产生,同时有白色沉淀生成,其沉淀量(纵坐标)与加入Na2O2的量(横坐标)的关系如图所示,根据以上判断在该溶液中一定存在的离子是( )
有一透明溶液,取出少量滴入BaCl2溶液,有白色沉淀生成;另取一定体积的该溶液加入过量Na2O2,有无色有刺激性味气体产生,同时有白色沉淀生成,其沉淀量(纵坐标)与加入Na2O2的量(横坐标)的关系如图所示,根据以上判断在该溶液中一定存在的离子是( )
①H+②NH4+③Al3+④Mg2+⑤Fe2+⑥NO3-⑦SO42-⑧CO32-.
 有一透明溶液,取出少量滴入BaCl2溶液,有白色沉淀生成;另取一定体积的该溶液加入过量Na2O2,有无色有刺激性味气体产生,同时有白色沉淀生成,其沉淀量(纵坐标)与加入Na2O2的量(横坐标)的关系如图所示,根据以上判断在该溶液中一定存在的离子是( )
有一透明溶液,取出少量滴入BaCl2溶液,有白色沉淀生成;另取一定体积的该溶液加入过量Na2O2,有无色有刺激性味气体产生,同时有白色沉淀生成,其沉淀量(纵坐标)与加入Na2O2的量(横坐标)的关系如图所示,根据以上判断在该溶液中一定存在的离子是( )①H+②NH4+③Al3+④Mg2+⑤Fe2+⑥NO3-⑦SO42-⑧CO32-.
| A. | ①②③④⑦ | B. | ①③④⑦ | C. | ①②③⑤⑦ | D. | ①③④⑧ |
8.以下现象与电化学腐蚀无关的是( )
| A. | 纯银物品久置表面变暗 | |
| B. | 生铁(含有碳等杂质)比纯铁在潮湿的环境中容易生锈 | |
| C. | 铁质器件附有铜质配件,在接触处易生铁锈 | |
| D. | 黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
5.下列说法正确的是( )
| A. | H2S溶液中只存在2个电离平衡 | |
| B. | c(OH-)=$\sqrt{{K}_{w}}$的溶液一定呈中性 | |
| C. | 加热碳酸钠溶液可证明其水解是吸热反应 | |
| D. | 常温下,在AlPO4和FePO4的饱和溶液中滴加少量Na3PO4溶液,Ksp(AlPO4)和Ksp(FePO4)将减小 |
12.下列能使湿润的红色石蕊试纸变蓝的气体是( )
| A. | NH3 | B. | SO3 | C. | HCl | D. | CO2 |
2.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,2.24 L乙醇中碳氢键的数目为0.5 NA | |
| B. | 1 L 0.1 mol•L-1硫酸钠溶液中含有的氧原子数为0.4 NA | |
| C. | 0.1 mol KI与0.1 mol FeCl3在溶液中反应转移的电子数为0.1 NA | |
| D. | 0.1 mol乙烯与乙醇的混合物完全燃烧所消耗的氧分子数为0.3 NA |
18.汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:汽车内燃机燃烧的高温引起氮气和氧气反应,这是汽车尾气里含有NO气体的原因之一.已知不同温度时,反应N2(g)+O2(g)?2NO(g)的平衡常数.
(1)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志AD.
A.消耗1mol N2同时生成1mol O2 B.混合气体密度不变
C.混合气体平均相对分子质量不变 D.2v(N2)正=v(NO)逆
(2)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是AC(填字母序号).

(3)在2400℃时向2L密闭容器中充入N2和O2各1mol,平衡时N2的转化率是4%(保留整数);平衡后再向其中充入1molNO,重新达到化学平衡状态,与原平衡状态相比,此时平衡混合气中NO的体积分数不变(填“变大”、“变小”或“不变”).
(4)为了减轻大气污染,人们提出通过以下反应来处理汽车尾气2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=a kJ•mol-1,为了测定在某种催化剂作用下该反应的反应速率,t℃时在一等容的密闭容器中,在上述条件下该反应能自发进行,某科研机构用气体传感器测得了不同时间的NO和CO的浓度如下表(CO2和N2的起始浓度均为0).
请回答下列问题:
①a小于0(填“大于”或“小于”).
②假设在密闭容器中发生上述处理汽车尾气反应,达到平衡时改变下列条件,能提高NO转化率的是
CD.
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积.
③t℃时2NO(g)+2CO(g)?N2(g)+2CO2(g)反应的平衡常数K=5000.
| 温度 | 1760℃ | 2400℃ | 2730℃ |
| 平衡常数 | 2.4×10-4 | 6.4×10-3 | 8.9×10-3 |
A.消耗1mol N2同时生成1mol O2 B.混合气体密度不变
C.混合气体平均相对分子质量不变 D.2v(N2)正=v(NO)逆
(2)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是AC(填字母序号).

(3)在2400℃时向2L密闭容器中充入N2和O2各1mol,平衡时N2的转化率是4%(保留整数);平衡后再向其中充入1molNO,重新达到化学平衡状态,与原平衡状态相比,此时平衡混合气中NO的体积分数不变(填“变大”、“变小”或“不变”).
(4)为了减轻大气污染,人们提出通过以下反应来处理汽车尾气2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=a kJ•mol-1,为了测定在某种催化剂作用下该反应的反应速率,t℃时在一等容的密闭容器中,在上述条件下该反应能自发进行,某科研机构用气体传感器测得了不同时间的NO和CO的浓度如下表(CO2和N2的起始浓度均为0).
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/10-4mol/L | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/10-3mol/L | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①a小于0(填“大于”或“小于”).
②假设在密闭容器中发生上述处理汽车尾气反应,达到平衡时改变下列条件,能提高NO转化率的是
CD.
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积.
③t℃时2NO(g)+2CO(g)?N2(g)+2CO2(g)反应的平衡常数K=5000.
19.在CO和CO2组成的混合气体中,两物质的质量比为14:11,则该混合气体中CO和CO2的物质的量比为?( )
| A. | 14:11 | B. | 2:1 | C. | 1:1 | D. | 1:2 |