题目内容
“套管实验”是将一支较小的玻璃仪器装入另一支玻璃仪器中,经组装来完成原来需要较多仪器进行的实验.因其具有许多优点,已被广泛地应用于化学实验.如图三组实验均为“套管实验”,通过观察、分析,回答下列问题:
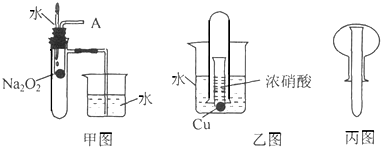
(1)甲图是对课本有关Na2O2某一性质的两个实验的改进.将甲图胶头滴管中的水滴到小试管里,然后在导管口A处进行适当的操作,便可完成实验.
①在A处进行操作的目的是 .
②根据观察到的现象可以得出两个结论:一是:Na2O2与H2O反应有O2生成;二是: .
③写出该反应的化学方程式 .
(2)乙图中,当小试管里的铜片和浓硝酸接触后,能观察到铜片与浓硝酸剧烈反应,铜片溶解,放出红棕色气体,随后气体的颜色逐渐变浅,小试管中溶液变蓝以及 等现象.乙中发生反应的离子方程式是 .
(3)用丙图中的装置(铁架台、药匙等辅助用品忽略)可以制备和收集满一瓶喷泉实验用的氨气.根据图中的装置需要选用的用品是(填字母) .
A、氯化铵固体 B、氧化钙 C、浓氨水
D、浓硫酸 E、湿润的红色石蕊试纸
(4)通过上述三组实验得知,套管实验中“外管”所起的作用通常有:封闭气体、便于观察气体的颜色、收集气体等,其中还有一个重要的作用是 .

(1)甲图是对课本有关Na2O2某一性质的两个实验的改进.将甲图胶头滴管中的水滴到小试管里,然后在导管口A处进行适当的操作,便可完成实验.
①在A处进行操作的目的是
②根据观察到的现象可以得出两个结论:一是:Na2O2与H2O反应有O2生成;二是:
③写出该反应的化学方程式
(2)乙图中,当小试管里的铜片和浓硝酸接触后,能观察到铜片与浓硝酸剧烈反应,铜片溶解,放出红棕色气体,随后气体的颜色逐渐变浅,小试管中溶液变蓝以及
(3)用丙图中的装置(铁架台、药匙等辅助用品忽略)可以制备和收集满一瓶喷泉实验用的氨气.根据图中的装置需要选用的用品是(填字母)
A、氯化铵固体 B、氧化钙 C、浓氨水
D、浓硫酸 E、湿润的红色石蕊试纸
(4)通过上述三组实验得知,套管实验中“外管”所起的作用通常有:封闭气体、便于观察气体的颜色、收集气体等,其中还有一个重要的作用是
考点:性质实验方案的设计
专题:实验评价题
分析:(1)甲图:过氧化钠和水反应,生成氢氧化钠和氧气,该反应为放热反应,实验的改进装置,A处检验生成的气体是氧气,套管验证该反应为放热反应.甲图中伸入烧杯液面下的导管有气泡冒出,说明该反应放热使套管间的气体受热膨胀.
①过氧化钠可以和水之间反应产生氧气,氧气具有助燃性,能使带火星的木条复燃,在A处进行操作的目的是检验产生气体的性质,确定其成分;
②根据过氧化钠可以和水之间反应产生氧气,该反应放热分析;③过氧化钠和水之间反应生成氢氧化钠和氧气,据此书写化学方程式;
(2)乙图:铜与浓硝酸中,反应生成Cu2+、NO2和H2O,开始放出红棕色气体,小试管内液面下降,浓硝酸随反应的进行变为稀硝酸,则反应快结束时铜和稀硝酸反应生成NO,二氧化氮气体和水反应生成无色气体NO,小试管内液面上升,结合离子方程式的书写方法书写相关反应的离子方程式;
(3)实验室可以采用氧化钙和浓氨水之间反应制取氨气,氨气密度比空气小,可以用向上排空气法收集;
(4)甲实验可以用外套管来检验反应的热量变化,乙装置可以用外套管封闭气体,避免空气污染,丙装置可以用外套管收集氨气.
①过氧化钠可以和水之间反应产生氧气,氧气具有助燃性,能使带火星的木条复燃,在A处进行操作的目的是检验产生气体的性质,确定其成分;
②根据过氧化钠可以和水之间反应产生氧气,该反应放热分析;③过氧化钠和水之间反应生成氢氧化钠和氧气,据此书写化学方程式;
(2)乙图:铜与浓硝酸中,反应生成Cu2+、NO2和H2O,开始放出红棕色气体,小试管内液面下降,浓硝酸随反应的进行变为稀硝酸,则反应快结束时铜和稀硝酸反应生成NO,二氧化氮气体和水反应生成无色气体NO,小试管内液面上升,结合离子方程式的书写方法书写相关反应的离子方程式;
(3)实验室可以采用氧化钙和浓氨水之间反应制取氨气,氨气密度比空气小,可以用向上排空气法收集;
(4)甲实验可以用外套管来检验反应的热量变化,乙装置可以用外套管封闭气体,避免空气污染,丙装置可以用外套管收集氨气.
解答:
解:(1)甲图:过氧化钠和水反应,生成氢氧化钠和氧气,该反应为放热反应,实验的改进装置,A处检验生成的气体是氧气,套管验证该反应为放热反应.
①氧气具有助燃性,能使带火星的木条复燃,观察图甲现象,木条复燃,说明过氧化钠可以和水之间反应产生氧气,所以在A处进行操作的目的是:检验产生气体的性质,确定其成分;
故答案为:检验产生气体的性质,确定其成分;
②在A处产生能使带火星的木条复燃的气体,说明Na2O2与H2O反应有O2生成,甲图中伸入烧杯液面下的导管有气泡冒出,说明该反应放热使套管间的气体受热膨胀,
故答案为:该反应放热;
③过氧化钠和水之间反应生成氢氧化钠和氧气,化学方程式为:2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(2)铜与浓硝酸中,Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O、其离子方程式为Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O,反应生成红棕色气体NO2,小试管内液面下降,浓硝酸随反应的进行变为稀硝酸,3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,其离子反应为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,反应生成无色的NO,二氧化氮气体和水反应生成无色气体NO,3NO2+H2O=2HNO3+NO,其离子反应为:3NO2+H2O=2H++2NO3-+NO,小试管内液面上升,
故答案为:液面先下降后上升;Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O、3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O、3NO2+H2O=2H++2NO3-+NO;
(3)因为氨水中存在NH3+H2O?NH3?H2O?NH4++OH- 氧化钙溶水产生大量OH-,使平衡逆向进行有利于NH3放出,同时氧化钙溶水放出大量热,使气体溶解度下降,有利于NH3放出,CaO+NH3?H2O=Ca(OH)2+NH3↑,所以可通过浓氨水和固体氧化钙作用获得氨气;可以取适量氧化钙、浓氨水放入小试管中,因为氨气是密度小于空气的,可以采用向上排空气法来收集,即将圆底烧瓶倒扣在小试管上,并使使管口接近烧瓶底,
故答案为:B、C;
(4)在上述实验中,甲实验可以用外套管来检验反应的热量变化,乙装置用外套管,是使得铜和硝酸之间反应的气体封闭,这样可以避免空气污染,丙装置可以用外套管来收集氨气,
故答案为:检验反应的热量变化.
①氧气具有助燃性,能使带火星的木条复燃,观察图甲现象,木条复燃,说明过氧化钠可以和水之间反应产生氧气,所以在A处进行操作的目的是:检验产生气体的性质,确定其成分;
故答案为:检验产生气体的性质,确定其成分;
②在A处产生能使带火星的木条复燃的气体,说明Na2O2与H2O反应有O2生成,甲图中伸入烧杯液面下的导管有气泡冒出,说明该反应放热使套管间的气体受热膨胀,
故答案为:该反应放热;
③过氧化钠和水之间反应生成氢氧化钠和氧气,化学方程式为:2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(2)铜与浓硝酸中,Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O、其离子方程式为Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O,反应生成红棕色气体NO2,小试管内液面下降,浓硝酸随反应的进行变为稀硝酸,3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,其离子反应为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,反应生成无色的NO,二氧化氮气体和水反应生成无色气体NO,3NO2+H2O=2HNO3+NO,其离子反应为:3NO2+H2O=2H++2NO3-+NO,小试管内液面上升,
故答案为:液面先下降后上升;Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O、3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O、3NO2+H2O=2H++2NO3-+NO;
(3)因为氨水中存在NH3+H2O?NH3?H2O?NH4++OH- 氧化钙溶水产生大量OH-,使平衡逆向进行有利于NH3放出,同时氧化钙溶水放出大量热,使气体溶解度下降,有利于NH3放出,CaO+NH3?H2O=Ca(OH)2+NH3↑,所以可通过浓氨水和固体氧化钙作用获得氨气;可以取适量氧化钙、浓氨水放入小试管中,因为氨气是密度小于空气的,可以采用向上排空气法来收集,即将圆底烧瓶倒扣在小试管上,并使使管口接近烧瓶底,
故答案为:B、C;
(4)在上述实验中,甲实验可以用外套管来检验反应的热量变化,乙装置用外套管,是使得铜和硝酸之间反应的气体封闭,这样可以避免空气污染,丙装置可以用外套管来收集氨气,
故答案为:检验反应的热量变化.
点评:本题是一道知识迁移的实验考查题,要求学生对所学的实验仪器灵活变通,对知识的掌握灵活熟练,考查学生分析和解决问题的能力,难度较大,解答本题的关键是要充分理解各种物质的性质及其物质之间相互作用时的实验现象.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
已知复印机工作时易产生臭氧,臭氧浓度过高时对人体有害,臭氧具有强氧化性,可以使湿润碘化钾淀粉试纸变蓝,其中臭氧部分转化成氧气,关于该反应的说法正确的是( )
| A、该反应的离子方程式为:2I-+O3+H2O═2OH-+I2+O2 |
| B、反应中每1mol臭氧参加反应电子转移数为6mol |
| C、O2是该反应的还原产物 |
| D、由该反应可知氧化性的大小顺序:O3>O2 |
在配制一定物质的量浓度的NaOH溶液时,下列哪个原因会造成所配溶液浓度偏高( )
| A、所用NaOH已经潮解 |
| B、向容量瓶中加水未到刻度线 |
| C、有少量NaOH溶液残留在烧杯里 |
| D、所用容量瓶不干燥 |