题目内容
已知某难溶电解质A2B的Ksp为3.2×10-5,将适量A2B固体溶于100mL水中至刚好饱和,该过程中A+和B2-浓度随时间变化关系如图.若t1时刻在上述体系中加入100mL 2.0mol?L-1 Na2B 溶液,下列示意图中(实线代表B2-,虚线代表A+),能正确表示t1时刻后A+和B2-浓度随时间变化趋势的是( )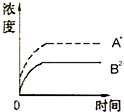

A、 |
B、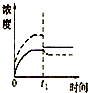 |
C、 |
D、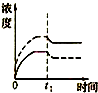 |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:计算溶液混合后银离子和硫酸根离子的浓度,再计算浓度幂之积,与平衡常数相比较,判断溶液离子浓度变化.
解答:
解:在A2B固体的饱和溶液中c(A+)=2c(B2-),c2(A+)?c(B2-)=3.2×10-5,则有c(A+)=4×10-2mol/L,c(B2-)=2×10-2mol/L.t1时刻向上述体系中加入100mL 2.0mol?L-1Na2B溶液,此时相当于先将原溶液稀释,A+的浓度变成2×10-2mol/L,B2-的浓度变成1.01mol/L,Q=c2(A+)?c(B2-)=(2×10-2)2×1.01=4.04×10-4>3.2×10-5,所以会生成A2B沉淀,两者的浓度会减小.
故选A.
故选A.
点评:本题考查本题考查了沉淀溶解平衡移动,考查了学生对图表、文字信息的获取与分析应用能力,要求学生掌握溶度积常数的基本概念以及简单应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
生产、生活离不开各种化学物质,下列说法不正确的是( )
| A、氧化铝可以用来制造耐火坩埚、耐火管和耐高温的实验仪器 |
| B、潜水艇在紧急情况下可用过氧化钠供氧 |
| C、氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂 |
| D、工业上常用硅制造光导纤维 |
下表列出了25℃时有关弱酸的电离平衡常数:则有关说法正确的是( )
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×l0-1 | K1=4.3×10-7 K2=5.6×10-11 |
| A、等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) |
| B、95℃纯水的pH<7,说明加热可导致水呈酸性 |
| C、pH=3的醋酸溶液,稀释至10倍后pH=4 |
| D、0.02mol/L的盐酸,与等体积水混合后pH=2 |