题目内容
 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.某学生为测定未知浓度的稀硫酸溶液,实验如下:以0.14mol?L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL
(1)该学生用标准0.14mol?L-1NaOH溶液滴定硫酸的实验操作如下:
a检查滴定管是否漏水
b取一定体积的待测液于锥形瓶中
c用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管
d装标准溶液和待测液并调整液面(记录初读数)
e用蒸馏水洗涤玻璃仪器
f把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
①滴定操作的正确顺序是(用序号填写)
②该滴定操作中应选用的指示剂是
③在f操作中如何确定终点?
(2)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视
(3)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果
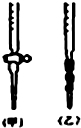
(4)如图用标准NaOH溶液滴定时,应将标准NaOH溶液注入
(5)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值
(6)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度(计算结果到小数点后二位)
考点:中和滴定
专题:实验题
分析:(1)a、根据中和滴定有检漏、洗涤、润洗、装液、调零、取待测液并加指示剂、滴定等操作;
b、氢氧化钠与HCl恰好中和溶液的pH为7,可选择酸性或碱性变色范围内的指示剂;
c、根据滴定结束前硫酸溶液的颜色及反应结束后混合液的颜色变化判断滴定终点;
(2)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化;
(3)碱式滴定管用蒸馏水润洗后,未用标准液润洗,则氢氧化钠溶液的浓度变小;
(4)碱性溶液盛放在碱式滴定管中;
(5)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则氢氧化钠的体积偏小;
(6)根据滴定消耗的氢氧化钠溶液的体积及反应方程式计算出待测液硫酸的物质的量浓度.
b、氢氧化钠与HCl恰好中和溶液的pH为7,可选择酸性或碱性变色范围内的指示剂;
c、根据滴定结束前硫酸溶液的颜色及反应结束后混合液的颜色变化判断滴定终点;
(2)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化;
(3)碱式滴定管用蒸馏水润洗后,未用标准液润洗,则氢氧化钠溶液的浓度变小;
(4)碱性溶液盛放在碱式滴定管中;
(5)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则氢氧化钠的体积偏小;
(6)根据滴定消耗的氢氧化钠溶液的体积及反应方程式计算出待测液硫酸的物质的量浓度.
解答:
解:(1)a、中和滴定有检漏、洗涤、润洗、装液、调零、取待测液并加指示剂、滴定等操作,所以滴定操作的正确顺序是aecdbf;
故答案为:aecdbf;
b、氢氧化钠与HCl恰好中和溶液的pH为7,可选择酸性变色范围内的指示剂甲基橙,也可选择碱性变色范围内的指示剂酚酞;
故答案为:甲基橙或酚酞;
c、用甲基橙作指示剂时,溶液由橙色变黄色,且半分钟内不变色,则到达滴定终点;用酚酞作指示剂时,溶液由无色变粉红色,且半分钟内不变色,则到达滴定终点;
故答案为:用甲基橙作指示剂时,溶液由橙色变黄色,且半分钟内不变色或用酚酞作指示剂时,溶液由无色变粉红色,且半分钟内不变色;
(2)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化,根据溶液颜色的变化判断终点;
故答案为:锥形瓶内溶液颜色的变化;
(3)碱式滴定管用蒸馏水润洗后,未用标准液润洗,则氢氧化钠溶液的浓度变小,滴定时消耗的氢氧化钠的体积偏大,所以计算结果偏大;
故答案为:偏大;
(4)碱性溶液盛放在碱式滴定管中,所以标准NaOH溶液注入碱式滴定管中,即乙图;故答案为:乙;
(5)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则氢氧化钠的体积偏小,所以测定的硫酸的浓度偏小;故答案为:偏小;
(6)根据反应:2NaOH+H2SO4=Na2SO4+2H2O,稀释后的硫酸溶液浓度为:c(H2SO4)=
=0.042mol/L,故答案为:0.04mol/L.
故答案为:aecdbf;
b、氢氧化钠与HCl恰好中和溶液的pH为7,可选择酸性变色范围内的指示剂甲基橙,也可选择碱性变色范围内的指示剂酚酞;
故答案为:甲基橙或酚酞;
c、用甲基橙作指示剂时,溶液由橙色变黄色,且半分钟内不变色,则到达滴定终点;用酚酞作指示剂时,溶液由无色变粉红色,且半分钟内不变色,则到达滴定终点;
故答案为:用甲基橙作指示剂时,溶液由橙色变黄色,且半分钟内不变色或用酚酞作指示剂时,溶液由无色变粉红色,且半分钟内不变色;
(2)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化,根据溶液颜色的变化判断终点;
故答案为:锥形瓶内溶液颜色的变化;
(3)碱式滴定管用蒸馏水润洗后,未用标准液润洗,则氢氧化钠溶液的浓度变小,滴定时消耗的氢氧化钠的体积偏大,所以计算结果偏大;
故答案为:偏大;
(4)碱性溶液盛放在碱式滴定管中,所以标准NaOH溶液注入碱式滴定管中,即乙图;故答案为:乙;
(5)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则氢氧化钠的体积偏小,所以测定的硫酸的浓度偏小;故答案为:偏小;
(6)根据反应:2NaOH+H2SO4=Na2SO4+2H2O,稀释后的硫酸溶液浓度为:c(H2SO4)=
| ||
| 0.025L |
点评:本题考查了酸碱中和滴定,题目难度中等,涉及了实验步骤、滴定方法、误差分析、浓度计算等知识,注意掌握误差分析的方法.

练习册系列答案
相关题目
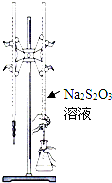 H2S2O3是一种弱酸,实验室欲用0.01mol?L-1的Na2S2O3溶液滴定I2溶液,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,下列说法合理的是( )
H2S2O3是一种弱酸,实验室欲用0.01mol?L-1的Na2S2O3溶液滴定I2溶液,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,下列说法合理的是( )| A、该滴定可用甲基橙做指示剂 |
| B、Na2S2O3是该反应的还原剂 |
| C、该滴定可选用如图所示装置 |
| D、该反应中每消耗2mol Na2S2O3,电子转移数为4mol |
用已经准确称量过的NaOH固体配制500mL1mol/L的NaOH溶液,供选择的仪器有:①玻璃棒②分液漏斗③胶头滴管④容量瓶⑤烧杯⑥烧瓶,必须选用的仪器有( )
| A、②③④ | B、①③④⑤ |
| C、③④⑤⑥ | D、①②④ |
下列变化(现象)的原理相同的是( )
| A、浓硫酸和浓盐酸敞口存放浓度均变小 |
| B、将单质铁和铜分别与单质硫加热反应均生成低价硫化物(FeS和Cu2S) |
| C、在过氧化氢水溶液中加入二氧化锰、在盛有锌粒和稀硫酸的溶液中滴加硫酸铜溶液,产生气体的速率均加快 |
| D、将氯化铝溶液和碳酸氢钠溶液分别用酒精灯加热蒸干,然后灼烧,最后均得到白色固体 |
下列关于有机物的说法错误的是( )
| A、CCl4可由CH4制得,可萃取碘水中的碘 |
| B、石油和天然气的主要成分都是碳氢化合物 |
| C、苯不能使酸性KMnO4溶液褪色,因此苯不能发生氧化反应 |
| D、淀粉和纤维素的化学式都为(C6H10O5)n,但不是同分异构体 |
下列关于 Na2CO3和NaHCO3性质比较中正确的是( )
| A、热稳定性:Na2CO3<NaHCO3 |
| B、等质量时与盐酸反应产生CO2的质量:Na2CO3<NaHCO3 |
| C、常温时水溶解性:Na2CO3<NaHCO3 |
| D、相对分子质量:Na2CO3<NaHCO3 |

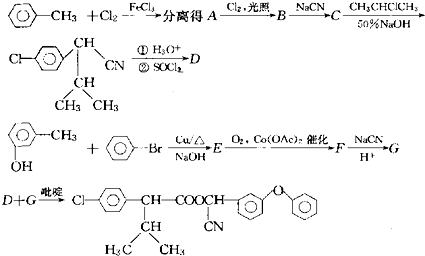
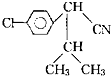
 (其中Ⅰ、Ⅱ为未知部分的结构),为推测X的分子结构,进行如图所示的转化过程:
(其中Ⅰ、Ⅱ为未知部分的结构),为推测X的分子结构,进行如图所示的转化过程: