题目内容
【题目】原电池是化学对人类的一项重大贡献。
Ⅰ(1).某兴趣小组为研究原电池原理,设计如图装置。a和b不连接时,烧杯中发生反应的现象是___________________________。
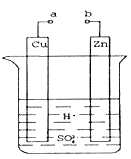
(2)a和b用导线连接,Cu极为原电池___________ (填“正”或“负”)极,电极反应式是___________ ,发生__________(填“氧化”或“还原”)反应。
(3)将a与直流电源的正极相连并把Cu换成石墨电极,b与直流电源的负极相连,则石墨电极反应式 ______________________,该过程的总反应方程式为_______________________。
【答案】锌片不断溶解,锌片周围有气泡产生 正极 2H++2e-=H2![]() 还原反应 2H2O-4e-=O2
还原反应 2H2O-4e-=O2![]() +4H+ 2H2O
+4H+ 2H2O ![]() O2
O2![]() +2H2
+2H2![]()
【解析】
(1)a和b不连接时,不能形成闭合回路,所以不能形成原电池;
(2))a和b用导线连接,较活泼的金属锌为负极,铜为正极;
(3)将a与直流电源的正极相连并把Cu换成石墨电极,为阳极,阳极上氢氧根离子失电子产生氧气,阴极上氢离子得电子产生氢气。
(1)该装置不能形成闭合回路,所以不能形成原电池,锌发生化学腐蚀,离子反应为Zn+2H+=H2↑+Zn2+,烧杯中发生反应的现象是:锌片不断溶解,锌片周围有气泡产生;
(2)该装置为原电池,锌易失电子作负极、Cu作正极,正极上氢离子放电发生还原反应,电极反应为2H++2e-=H2↑,
故答案为:正极;2H++2e-=H2![]() ;还原反应;
;还原反应;
(3)将a与直流电源的正极相连并把Cu换成石墨电极,b与直流电源的负极相连为阴极,则石墨电极为阳极,阳极上水电离出的氢氧根离子失电子产生氧气,电极反应式为2H2O-4e-=O2![]() +4H+,阴极上氢离子得电子产生氢气,则该过程的实质为电解水,总反应方程式为2H2O
+4H+,阴极上氢离子得电子产生氢气,则该过程的实质为电解水,总反应方程式为2H2O ![]() O2
O2![]() +2H2
+2H2![]() 。
。

【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 向 | 溶液橙色变深 | 增大生成物浓度,平衡 |
B | 向较浓的 |
|
|
C | 取 | 溶液中出现砖红色 | 淀粉完全水解 |
D | 分别向 | 加入 | 反应物的浓度越大,反应速率越快 |
A.AB.BC.CD.D