题目内容
14.NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 1.8g重水中含有的电子数为NA | |
| B. | 1L0.1mol/L FeCl3溶液中含有的Cl- 数为0.3NA | |
| C. | 25℃,1L pH=13的Ba(OH)2溶液中含有的oH-数为0.2NA | |
| D. | 标准状况下,2.24L NO和NO2混合气体中含有的氧原子数为0.15NA |
分析 A.重水的摩尔质量为20g/mol,1mol重水含有10mol电子;
B.依据n=CV计算氯离子的物质的量及个数;
C.PH=13的Ba(OH)2溶液中c(OH- )=0.1mol/L;
D.依据n=$\frac{V}{22.4}$计算标准状况气体物质的量结合极值方法分析
解答 解:A.1.8g重水的物质的量为0.09mol,含有0.9mol电子,含有的电子数为0.09NA,故A错误;
B.1L0.1mol/L FeCl3溶液中含有的Cl- 数=1L×0.1mol/L×3×NA=0.3NA,故B正确;
C.PH=13的Ba(OH)2溶液中c(OH- )=0.1mol/L,1L PH=13的Ba(OH)2溶液中含有0.1NA个OH- 离子,故C错误;
D.依据n=$\frac{V}{22.4}$计算标准状况气体物质的量=0.1mol,结合极值方法分析,2.24 L NO和NO2混合气体中含有的氧原子数在0.1-0.2之间,不一定是0.15NA,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的运用以及物质的状态和结构是解题关键,题目难度不大.

练习册系列答案
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
5.下列说法不正确的是( )
| A. | 25℃时,pH=11 NaOH溶液和pH=3 CH3COOH混合,若溶液显酸性,则所得溶液中离子浓度可能为c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| B. | 取c(H+)=0.01mol/L的盐酸和醋酸各100mL,分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大 | |
| C. | 25℃时,某溶液中由水电离出的c(H+)=10-amol/L,若a>7时,该溶液pH一定为14-a | |
| D. | 含等物质的量的NaHC2O4和Na2C2O4的溶液中存在:2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
2.在实验室进行物质制备,下列从原料及试剂分别制取相应的最终产物的设计中,理论上正确、操作上可行、经济上合理的是(少量杂质忽略不计)( )
| A. | C$\stackrel{在空气中点燃}{→}$CO$\stackrel{CuO△}{→}$CO2$\stackrel{NaOH溶液}{→}$Na2CO3 | |
| B. | CaO$\stackrel{H_{2}O}{→}$Ca(OH)2 溶液$\stackrel{NaCO_{3}溶液}{→}$NaOH溶液 | |
| C. | Fe$\stackrel{点燃}{→}$ $F{e}_{2{O}_{3}}$$\stackrel{H_{2}SO_{4}}{→}$Fe2(SO4)3溶液 | |
| D. | Cu$\stackrel{AgNO_{3}溶液}{→}$Cu(NO3)2溶液$\stackrel{NaOH溶液}{→}$Cu(OH)2 |
9.某有机物A的分子式为C4H8O2,下列有关分析正确的是( )
| A. | 若A遇NaHCO3溶液有气体生成,则A的结构共有4种 | |
| B. | 若A遇稀硫酸能生成两种有机物,则A的结构共有4种 | |
| C. | 若A能发生银镜反应,则A的结构有2种 | |
| D. | 若A既能和新制Cu(OH)2反应产生砖红色沉淀,又能和金属钠反应放出H2,则A的结构有3种 |
19.下列酸与金属发生反应时,硫元素或氮元素的化合价不发生变化的是( )
| A. | 浓硫酸 | B. | 稀硝酸 | C. | 浓硝酸 | D. | 稀硫酸 |
3.固体X只可能由A1、(NH4)2SO4、MgCl2、FeCl2、AlCl3、AgNO3中的一种或几种组成,某同学对该固体进行了如图实验,下列判断正确的是( )
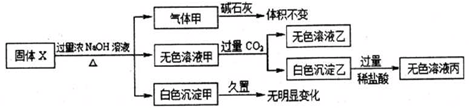

| A. | 气体甲一定是纯净物 | |
| B. | 将过量的无色溶液乙和少量无色溶液丙混合既有无色气体生成,也有白色沉淀生成 | |
| C. | 固体X中一定存在AlCl3、(NH4)2SO4,MgCl2 | |
| D. | 白色沉淀甲可能是混合物 |
4.下列说法正确的是( )
| A. | 含有CH3COONa的溶液都能增大水的电离程度 | |
| B. | pH=5的HCl与pH=5的NH4Cl等体积混合,溶液pH仍为5 | |
| C. | 将AgI和AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,产生的沉淀主要是AgBr | |
| D. | 20mL0.1mol/LNH3•H2O与10mL0.1mol/LHCl充分反应,所得溶液pH=9中c(NH3•H2O)>c(Cl-)>c(OH-) |
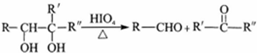
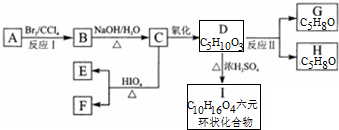
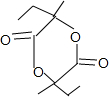 +2H2O.
+2H2O. .
.