题目内容
6.亚硝酸钠(NaN02)外观酷似食盐,但它是-种有毒的物质.误食亚硝酸钠会使人体血液中的Fe2+转化为Fe3+而引起中毒,服用维生素C可使Fe3+转化为Fe2+,从而达到解毒的目的.转化过程可表示为Fe2+$?_{2、维生素C}^{1、NaN_{02}}$Fe3+转化1中,氧化剂是NaNO2,转化2中,维生素C表现还原性.分析 转化1中,Fe元素化合价由+2价变为+3价,则亚铁离子被氧化而作还原剂,亚硝酸钠作氧化剂;转化2中,Fe元素化合价由+3价变为+2价,铁元素得电子而作氧化剂,则维生素C作还原剂.
解答 解:转化1中,Fe元素化合价由+2价变为+3价,则亚铁离子被氧化而作还原剂,亚硝酸钠作氧化剂,体现氧化性;转化2中,Fe元素化合价由+3价变为+2价,铁元素得电子而作氧化剂,则维生素C作还原剂,维生素C体现还原性,
故答案为:NaNO2;还原.
点评 本题考查氧化还原反应,侧重考查氧化还原反应的基本理论,题目难度不大.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
16.除去如表物质中所含杂质(括号内为杂质),选用的试剂或分离方法正确的是( )
| 混合物 | 试剂 | 分离方法 | |
| A | Fe(碘) | - | 加热 |
| B | 二氧化碳(氯化氢) | 饱和Na2CO3溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 淀粉(氯化钠) | 蒸馏水 | 渗析 |
| A. | A | B. | B | C. | C | D. | D |
17.在大型演唱晚会上,观众经常使用荧光棒来增添喜庆气氛.荧光棒内草酸二苯酯和过氧化氢反应导致发光的原理大致如下:①草酸二苯酯+H2O2→C2O4+2C6H5OH;②生成的中间产物把能量传递给染料:C2O4+染料→染料*(电子激发态)+2CO2,电子激发态的染料不稳定,借发光而回到基态.下列说法不正确的是( )
| A. | 草酸二苯酯的分子式是C14H10O4 | |
| B. | 上述变化证明化学能可以转化为光能 | |
| C. | C2O4的结构简式 | |
| D. | 反应①属于酯水解反应 |
14.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1.8g重水中含有的电子数为NA | |
| B. | 1L0.1mol/L FeCl3溶液中含有的Cl- 数为0.3NA | |
| C. | 25℃,1L pH=13的Ba(OH)2溶液中含有的oH-数为0.2NA | |
| D. | 标准状况下,2.24L NO和NO2混合气体中含有的氧原子数为0.15NA |
1.下列物质中只含有共价键的是( )
| A. | H202 | B. | NaCl | C. | NH4CI | D. | AI2O3 |
18.下列说法不正确的是( )
| A. | 氢氧燃料电池要进入广泛的实际应用,高容量储氢材料的研制是需解决的关键技术问题之一 | |
| B. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| C. | 2013年6月航天员王亚平在太空做的水膜实验说明:水分子的组成和结构在太空中发生了改变,水才有不同于其在地球上的物理现象 | |
| D. | 元素分析仪可检验C、H、O、N、S等非金属元素,也可以检验Cr、Mn等金属元素 |
15.取某一元醇13.00g跟乙酸混合后,加入浓硫酸并加热,若反应完毕时,制得乙酸某酯15.80g,回收该一元醇1.40g.则该一元醇是( )
| A. | C7H15OH | B. | C6H13OH | C. | C5H12OH | D. | C2H5OH |
 二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向.
二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向.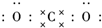 ,所含化学键的类型是共价键.
,所含化学键的类型是共价键.


