题目内容
某学生配制100mL 0.5mol/L K2SO4溶液时有如下操作.
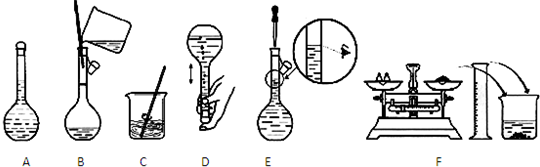
(1)上述操作的正确顺序应该是 → → → → → (填写编号);
(2)则需要固体K2SO4的质量是 g:
(3)请指出上述操作中的一处错误并纠正. ;
(4)实验结束后发现该生所配溶液浓度偏大,请写出一条可能的原因: ;
(5)写出K2SO4在水溶液中的电离方程式: ;
(6)若检验某一溶液中是否含有SO42-,应如何操作? .

(1)上述操作的正确顺序应该是
(2)则需要固体K2SO4的质量是
(3)请指出上述操作中的一处错误并纠正.
(4)实验结束后发现该生所配溶液浓度偏大,请写出一条可能的原因:
(5)写出K2SO4在水溶液中的电离方程式:
(6)若检验某一溶液中是否含有SO42-,应如何操作?
考点:配制一定物质的量浓度的溶液
专题:实验题
分析:(1)根据操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作进行判断;
(2)根据m=nM=cVM计算;
(3)用天平称量物体质量时,左盘放物体,右盘放砝码;
(4)根据c=
分析,溶质的物质的量偏大或对溶液的体积偏小都可;
(5)硫酸钾是可溶于水的盐,属于强电解质,水溶液中完全电离;
(6)在检验是否含有硫酸根离子时,如果对溶液成分没有限制,则需要可能存在的其他微粒如碳酸根离子、银离子等的干扰.
(2)根据m=nM=cVM计算;
(3)用天平称量物体质量时,左盘放物体,右盘放砝码;
(4)根据c=
| n |
| V |
(5)硫酸钾是可溶于水的盐,属于强电解质,水溶液中完全电离;
(6)在检验是否含有硫酸根离子时,如果对溶液成分没有限制,则需要可能存在的其他微粒如碳酸根离子、银离子等的干扰.
解答:
解:(1)操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到100mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,
故答案为:F;C;B;D;E;A;
(2)需要固体K2SO4的质量是m=nM=cVM=0.1L×0.5mol/L×174g/mol=8.7g,托盘天平只能精确到0.1,所以应称量8.7g,故答案为:8.7;
(3)用天平称量物体质量时,左盘放物体,右盘放砝码,所以F错了;
故答案为:药瓶和砝码放颠倒了;左盘放物体,右盘放砝码;
(4)定容时,俯视刻度线,会导致溶液体积偏小,溶液浓度偏大;
故答案为:定容时,俯视刻度线;
(5)K2SO4是强电解质水溶液中完全电离,K2SO4=2K++SO42-;
故答案为:K2SO4=2K++SO42-;
(6)先加稀盐酸,可以排除银离子与碳酸根离子,再加入BaCl2溶液,产生的沉淀只能是硫酸钡,即含有SO42-;
故答案为:先加稀盐酸,再加入BaCl2溶液,产生白色沉淀,含有SO42-,反之,不含.
故答案为:F;C;B;D;E;A;
(2)需要固体K2SO4的质量是m=nM=cVM=0.1L×0.5mol/L×174g/mol=8.7g,托盘天平只能精确到0.1,所以应称量8.7g,故答案为:8.7;
(3)用天平称量物体质量时,左盘放物体,右盘放砝码,所以F错了;
故答案为:药瓶和砝码放颠倒了;左盘放物体,右盘放砝码;
(4)定容时,俯视刻度线,会导致溶液体积偏小,溶液浓度偏大;
故答案为:定容时,俯视刻度线;
(5)K2SO4是强电解质水溶液中完全电离,K2SO4=2K++SO42-;
故答案为:K2SO4=2K++SO42-;
(6)先加稀盐酸,可以排除银离子与碳酸根离子,再加入BaCl2溶液,产生的沉淀只能是硫酸钡,即含有SO42-;
故答案为:先加稀盐酸,再加入BaCl2溶液,产生白色沉淀,含有SO42-,反之,不含.
点评:本题考查了一定物质的量浓度溶液的配制,注意从c=
理解配制原理,并判断不当操作引起的误差,注意托盘天平的使用方法.
| n |
| V |

练习册系列答案
相关题目
下列各图均是与金属腐蚀有关的图片,关于各图中的说法正确的是( )


| A、图1,燃气灶的中心部位发生的是吸氧腐蚀 |
| B、图2,海水中的铁棒,插入海水中的部分腐蚀会更加严重 |
| C、图3,在烧杯中滴加几滴KSCN溶液,溶液不会变红色 |
| D、图4,属于牺牲阳极的阴极保护法,不可用镁作阳极来防止地下钢铁管道的腐蚀 |
下列装置或操作能达到实验目的(必要的夹持装置及石棉网已省略)的是( )
A、 酸性KMnO4溶液中出现气泡且颜色逐渐褪去 |
B、 实验室制乙炔并验证其性质 |
C、 实验室中分馏石油 |
D、 分离碘酒中的碘和酒精 |
 如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气的混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间.
如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气的混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间.