题目内容
化学是一门以实验为基础的自然科学,根据已有实验知识回答下列问题.
(1)下列说法错误的 .
A.将Cl2通入紫色石蕊试液,溶液先变红后褪色
B.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
C.配制1L 0.5mol?L-1的NaCl溶液,需用托盘天秤称量29.25g NaCl固体
D.常温下,可以用铁质容器储运浓硝酸
E.实验室保存硫酸亚铁溶液,需在试剂瓶内加入铁粉或铁钉,防止硫酸亚铁被氧化
F.实验室可以用加热氯化铵的方法制取少量氨气
G.除去KCl溶液中少量MgCl2:加入适量NaOH溶液,过滤
(2)已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用如图所示的装置进行实验.实验过程中需从导管a处缓缓鼓入一定量的空气.
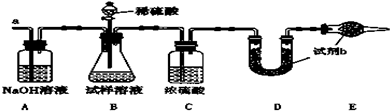
①装置E的名称 ,试剂b为 .
②实验过程中需要测定的数据除样品质量外有: (填序号).
A.反应前后装置C的质量 B.反应前后装置D的质量 C.反应前后装置E的质量
③若去掉装置A,则测定结果 (填“偏高”“偏低”或“无影响”).
(3)某不纯的烧碱样品,含Na2CO3 3.8%(质量百分含量)、H2O 5.8%、NaHCO3 0.004%.取m g样品溶于40mL 2mol/L的盐酸后,并用2mol/L NaOH溶液中和剩余的酸,在蒸发后可得干燥的固体的质量为 (选择下列正确的选项填空)
A.4.68g B.5.58g C.2.34g D.3.34g.
(1)下列说法错误的
A.将Cl2通入紫色石蕊试液,溶液先变红后褪色
B.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
C.配制1L 0.5mol?L-1的NaCl溶液,需用托盘天秤称量29.25g NaCl固体
D.常温下,可以用铁质容器储运浓硝酸
E.实验室保存硫酸亚铁溶液,需在试剂瓶内加入铁粉或铁钉,防止硫酸亚铁被氧化
F.实验室可以用加热氯化铵的方法制取少量氨气
G.除去KCl溶液中少量MgCl2:加入适量NaOH溶液,过滤
(2)已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用如图所示的装置进行实验.实验过程中需从导管a处缓缓鼓入一定量的空气.

①装置E的名称
②实验过程中需要测定的数据除样品质量外有:
A.反应前后装置C的质量 B.反应前后装置D的质量 C.反应前后装置E的质量
③若去掉装置A,则测定结果
(3)某不纯的烧碱样品,含Na2CO3 3.8%(质量百分含量)、H2O 5.8%、NaHCO3 0.004%.取m g样品溶于40mL 2mol/L的盐酸后,并用2mol/L NaOH溶液中和剩余的酸,在蒸发后可得干燥的固体的质量为
A.4.68g B.5.58g C.2.34g D.3.34g.
考点:探究物质的组成或测量物质的含量,化学实验方案的评价
专题:实验探究和数据处理题,实验评价题
分析:(1)A.酸能使紫色石蕊试液变红色,次氯酸具有漂白性;
B.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出;
C.托盘天平的感量是0.1g;
D.常温下,铁和浓硝酸发生钝化现象;
E.亚铁离子不稳定,易被空气氧化;
F.实验室可以用加热氯化铵和氢氧化钙混合物的方法制取少量氨气;
G.除去KCl溶液中少量MgCl2:加入适量KOH溶液,过滤;
(2)①由图可知,E为球形干燥管,试剂b为固体干燥剂,吸收空气中的二氧化碳和水;
②测定试样中纯碱的质量分数,需要知道D反应前后质量的变化,确定二氧化碳的质量;
③去掉装置A,从导管a处缓缓鼓入一定量的空气,不能除去二氧化碳,D中增重偏大;
(3)最后溶液中的溶质是氯化钠,根据氯原子守恒计算固体质量.
B.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出;
C.托盘天平的感量是0.1g;
D.常温下,铁和浓硝酸发生钝化现象;
E.亚铁离子不稳定,易被空气氧化;
F.实验室可以用加热氯化铵和氢氧化钙混合物的方法制取少量氨气;
G.除去KCl溶液中少量MgCl2:加入适量KOH溶液,过滤;
(2)①由图可知,E为球形干燥管,试剂b为固体干燥剂,吸收空气中的二氧化碳和水;
②测定试样中纯碱的质量分数,需要知道D反应前后质量的变化,确定二氧化碳的质量;
③去掉装置A,从导管a处缓缓鼓入一定量的空气,不能除去二氧化碳,D中增重偏大;
(3)最后溶液中的溶质是氯化钠,根据氯原子守恒计算固体质量.
解答:
解:(1)A.氯气和水反应生成盐酸和次氯酸,溶液呈酸性,次氯酸有漂白性,所以溶液先变红后褪色,故A正确;
B.分液时,应避免上下层液体混合,则分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出,故B正确;
C.托盘天秤称量29.25gNaCl,读数不合理,托盘天平只能准确到0.1g,故C错误;
D.常温下,Fe遇浓硝酸发生钝化,则常温下,可以用铁质容器储运浓硝酸,故D正确;
E.保存硫酸亚铁溶液,应防止亚铁离子被氧化,所以在试剂瓶内加入铁粉或铁钉,防止硫酸亚铁被氧化,故E正确;
F.氯化铵分解生成氨气和HCl,在试管口又化合生成氯化铵,收集不到氨气,不能利用此法制备氨气,故F错误;
G.除去KCl溶液中少量MgCl2:加入适量KOH溶液,过滤,加入NaOH时,会引进新的杂质,故G错误
故答案为:CFG;
(2)①由图可知,E为球形干燥管,试剂b为固体干燥剂,吸收空气中的二氧化碳和水,则b为碱石灰,故答案为:干燥管;碱石灰;
②测定试样中纯碱的质量分数,需要知道D反应前后质量的变化,确定二氧化碳的质量,由碳酸钠与硫酸反应可知碳酸钠的质量,最后得到质量分数,故答案为:B;
③去掉装置A,从导管a处缓缓鼓入一定量的空气,不能除去二氧化碳,D中增重偏大,即二氧化碳质量偏大,则由C元素守恒可知碳酸钠的质量分数偏高,故答案为:偏高;
(3)样品中Na2CO3、NaHCO3以及NaOH和盐酸反应最终产物都为NaCl,盐酸的物质的量为0.04L×2mol/L=0.08mol,根据Cl元素守恒可知,生成固体NaCl的物质的量也为0.08mol,则NaCl的质量为0.08mol×58.5g/mol=4.68g.
故选A.
B.分液时,应避免上下层液体混合,则分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出,故B正确;
C.托盘天秤称量29.25gNaCl,读数不合理,托盘天平只能准确到0.1g,故C错误;
D.常温下,Fe遇浓硝酸发生钝化,则常温下,可以用铁质容器储运浓硝酸,故D正确;
E.保存硫酸亚铁溶液,应防止亚铁离子被氧化,所以在试剂瓶内加入铁粉或铁钉,防止硫酸亚铁被氧化,故E正确;
F.氯化铵分解生成氨气和HCl,在试管口又化合生成氯化铵,收集不到氨气,不能利用此法制备氨气,故F错误;
G.除去KCl溶液中少量MgCl2:加入适量KOH溶液,过滤,加入NaOH时,会引进新的杂质,故G错误
故答案为:CFG;
(2)①由图可知,E为球形干燥管,试剂b为固体干燥剂,吸收空气中的二氧化碳和水,则b为碱石灰,故答案为:干燥管;碱石灰;
②测定试样中纯碱的质量分数,需要知道D反应前后质量的变化,确定二氧化碳的质量,由碳酸钠与硫酸反应可知碳酸钠的质量,最后得到质量分数,故答案为:B;
③去掉装置A,从导管a处缓缓鼓入一定量的空气,不能除去二氧化碳,D中增重偏大,即二氧化碳质量偏大,则由C元素守恒可知碳酸钠的质量分数偏高,故答案为:偏高;
(3)样品中Na2CO3、NaHCO3以及NaOH和盐酸反应最终产物都为NaCl,盐酸的物质的量为0.04L×2mol/L=0.08mol,根据Cl元素守恒可知,生成固体NaCl的物质的量也为0.08mol,则NaCl的质量为0.08mol×58.5g/mol=4.68g.
故选A.
点评:本题考查了物质含量的测定、化学实验方案评价,综合性较强,侧重混合物的分离和提纯、物质含量的测定等知识点的考查,结合实验方案的可行性、操作规范性等知识点分析,注意E装置的作用,为易错点.

练习册系列答案
相关题目
根据氢原子和氯原子的核外电子排布,对Cl2和HCl分子中形成的共价键描述正确的( )
| A、两者都为s-sσ键 |
| B、两者都为p-pσ键 |
| C、前者为p-pσ键,后者为s-pσ键 |
| D、前者为s-sσ键,后者为s-pσ键 |
下列实验现象描述正确的是( )
| A、NaOH溶液中滴入酚酞试液,溶液呈无色 |
| B、品红溶液中通入SO2气体,溶液呈紫色 |
| C、FeCl3溶液中滴入KSCN溶液,溶液呈蓝色 |
| D、新制Cu(OH)2悬浊液中加入葡萄糖溶液并加热,产生砖红色沉淀 |
 SiO2、SO2、NaOH、H2O、卤素及其化合物是中学化学中的常见物质,他们在生产、生活中有着广泛的应用,请回答下列有关问题:
SiO2、SO2、NaOH、H2O、卤素及其化合物是中学化学中的常见物质,他们在生产、生活中有着广泛的应用,请回答下列有关问题: