题目内容
下列说法正确的是( )
| A、Li在氧气中燃烧主要生成Li2O2 |
| B、砹位于第七周期第ⅦA族,其氢化物的稳定性大于氯化氢 |
| C、卤族元素单质的熔沸点随原子序数的增大而升高 |
| D、第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性 |
考点:非金属在元素周期表中的位置及其性质递变的规律,金属在元素周期表中的位置及其性质递变的规律
专题:元素周期律与元素周期表专题
分析:A、Li金属性比Na的弱,不生成Li2O2;
B、非金属性越强,氢化物越稳定;
C、组成结构相似的分子晶体,相对分子质量越大,熔沸点越高;
D、氨气溶于水,溶液显碱性.
B、非金属性越强,氢化物越稳定;
C、组成结构相似的分子晶体,相对分子质量越大,熔沸点越高;
D、氨气溶于水,溶液显碱性.
解答:
解:A、Li金属性比Na的弱,Li与氧气反应不生成Li2O2,生成Li2O,故A错误;
B、非金属性越强,氢化物越稳定,同主族从上到下非金属性依次减弱,则氢化物的稳定性依次减弱,所以砹的氢化物的稳定性小于氯化氢,故B错误;
C、组成结构相似的分子晶体,相对分子质量越大,熔沸点越高,卤族元素单质随原子序数相对分子质量增大,则熔沸点升高,故C正确;
D、第二周期非金属元素的气态氢化物溶于水后,水溶液不一定为酸性,如氨气溶于水,溶液显碱性,故D错误;
故选C.
B、非金属性越强,氢化物越稳定,同主族从上到下非金属性依次减弱,则氢化物的稳定性依次减弱,所以砹的氢化物的稳定性小于氯化氢,故B错误;
C、组成结构相似的分子晶体,相对分子质量越大,熔沸点越高,卤族元素单质随原子序数相对分子质量增大,则熔沸点升高,故C正确;
D、第二周期非金属元素的气态氢化物溶于水后,水溶液不一定为酸性,如氨气溶于水,溶液显碱性,故D错误;
故选C.
点评:本题考查了元素周期律和元素周期表的应用,侧重于基础知识的考查,题目难度不大.

练习册系列答案
相关题目
下列微粒中,哪一组中的化学键含有非极性共价键( )
①C2H6 ②H2S ③CH2Cl2 ④NH4+.
①C2H6 ②H2S ③CH2Cl2 ④NH4+.
| A、①②③④ | B、只有① |
| C、只有①③ | D、只有②③ |
太阳能电池常用的主要材料是( )
| A、高纯硅 | B、活性炭 |
| C、铁合金 | D、金属钠 |
在下列物质中,属于离子化合物的是( )
| A、HCl |
| B、H2O |
| C、NaCl |
| D、Cl2 |
实验室需配制一种仅含四种离子(不包括水电离的离子)的混合溶液,且在混合溶液中四种离子的物质的量浓度均为0.5mol/L,下列四个选项中能达到此目的是( )
| A、Fe2+ Na+ NO3- Cl- |
| B、Mg2+ NH4+ SO42- NO3- |
| C、H+ K+ Cl- CH3COO- |
| D、K+ NH4+ CO32- OH- |
某溶液中加入铝片有氢气产生,则在该溶液中一定能够大量共存的离子组是( )
| A、NH4+、Ba2+、Cl-、HCO3- |
| B、Na+、K+、SO42-、Cl- |
| C、K+、Na+、Ba2+、Cl- |
| D、SO42-、CH3COO-、Al3+、Mg2+ |
关于合理饮食有利于健康的下列说法正确的是( )
| A、没有水就没有生命 |
| B、饮用水越纯净越好 |
| C、养成良好的饮食习惯,只吃蔬菜,水果等碱性食物 |
| D、调味剂和营养剂加的越多越好 |
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是( )

| A、CO2(g)+H2(g)?CO(g)+H2O(g);△H>0 |
| B、CO2(g)+2NH3(g)?CO(NH2)2(s)+H2O(g);△H<0 |
| C、CH3CH2OH(g)?CH2=CH2(g)+H2O(g);△H>0 |
| D、2C6H5CH2CH3(g)+O2(g)?2C6H5CH═CH2(g)+2H2O(g);△H<0 |
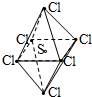 SCl6是一种无色的很稳定的物质,可用于灭火.SCl6的分子结构如图所示,呈正八面体型.如果氯元素有两种稳定的同位素,则SCl6的不同的分子种数为( )
SCl6是一种无色的很稳定的物质,可用于灭火.SCl6的分子结构如图所示,呈正八面体型.如果氯元素有两种稳定的同位素,则SCl6的不同的分子种数为( )