题目内容
13. 化学与人类生产和生活中密切相关,掌握有关的化学基础知识可以改善我们的生活.
化学与人类生产和生活中密切相关,掌握有关的化学基础知识可以改善我们的生活.[I]日常生活中使用的各种电池就是利用化学反应将化学能转化为电能,各种各样的电池的发展是化学对人类的一项重大贡献.请回答下列有关化学电源的问题:
(1)下列有关电池的叙述中正确的是C.
A.锌锰干电池工作一段时间后碳棒变细 B.氢氧燃料电池可将热能直接转变为电能
C.甲烷燃料电池工作时甲烷在负极被氧化 D.太阳能电池的主要材料是高纯度的二氧化硅
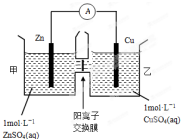
(2)锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过.下列有关叙述正确的是CD.
A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的c(SO42-)减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.甲池中的阳离子向乙池移动,保持溶液中电荷平衡
(3)航天技术上使用的氢一氧燃料电池具有高能、轻便和不污染环境等优点.氢一氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式都可表示为2H2+O2=2H2O.酸式氢一氧燃料电池的电解质是酸,放电时其正极的电极反应可表示为O2+4e-+4H+=2H2O,放电一段时间后电解质溶液的pH将变大(填“变大”、“变小”、“不变”).
[II]自来水厂生产自来水时,需要用到净水剂,对水进行消毒杀菌处理.
(4)漂白粉是常用的一种消毒剂,保存不当容易变质,有关化学方程式为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑.漂白粉不能与家庭中常用的洁厕剂(一种酸性液体,主要含HCl)混合使用,否则容易造成人体中毒,其原因是(用有关的离子方程式表示)ClO-+Cl-+2H+=Cl2↑+H2O.
(5)高铁酸钾(K2FeO4)足一种新型多功能水处理剂.工业上有多种方法制备高铁酸钾,其中一种方法是在氢氧化钾溶液中用次氯酸钠氧化氢氧化铁.该反应的可用离子方程式表示为2Fe(OH)3+3ClO-+4OH-=3Cl-+2FeO42-+5H2O.
(6)用高铁酸钾和锌制成的高铁碱性电池,能储存比普通碱性电池多50%的电能,己知该电池的总反应为2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,则负极的电极反应是Zn-2e-+2OH-=ZnO+H2O.
分析 Ⅰ(1)A.锌锰干电池碳棒不发生变化;
B.氢氧燃料电池可将化学能直接转变为电能;
C.甲烷燃料电池工作时甲烷在负极被氧化;
D.太阳能电池的主要材料是高纯度的硅;
(2)由图象可知,该原电池反应式为:Zn+Cu2+=Zn2++Cu,Zn发生氧化反应,为负极,Cu电极上发生还原反应,为正极,阳离子交换膜只允许阳离子和水分子通过,两池溶液中硫酸根浓度不变,随反应进行,甲池中的Zn2+通过阳离子交换膜进入乙池,以保持溶液呈电中性,进入乙池的Zn2+与放电的Cu2+的物质的量相等,而Zn的摩尔质量大于Cu,故乙池溶液总质量增大;
(3)酸性氢氧燃料电池在正极上放电的是氧气,电极反应式:O2+4e-+4H+=2H2O;碱性氢氧燃料电池在负极放电的是氢气,负极反应式为:H2-2e-+2OH-=2H2O;
Ⅱ(4)碳酸酸性比次氯酸强,二氧化碳与次氯酸钙反应生成碳酸钙和次氯酸;洁厕剂主要成分为盐酸,与次氯酸钙反应生成氯化钙和氯气;
(5)在氢氧化钾溶液中用次氯酸钠氧化氢氧化铁,生成高铁酸钾,结合质量守恒平衡;
(6)负极锌被氧化.
解答 解:Ⅰ(1)A.锌锰干电池碳棒不发生变化,起到导电作用,故A错误;
B.氢氧燃料电池可将化学能直接转变为电能,故B错误;
C.甲烷燃料电池工作时甲烷在负极被氧化,氧气为正极,故C正确;
D.太阳能电池的主要材料是高纯度的硅,故D错误.
故答案为:C;
(2)A.由图象可知,该原电池反应式为:Zn+Cu2+=Zn2++Cu,Zn为负极,发生氧化反应,Cu为正极,发生还原反应,故A错误;
B.阳离子交换膜只允许阳离子和水分子通过,故两池中c(SO42-)不变,故B错误;
C.甲池中的Zn2+通过阳离子交换膜进入乙池,乙池中发生反应:Cu2++2e-=Cu,保持溶液呈电中性,进入乙池的Zn2+与放电的Cu2+的物质的量相等,而Zn的摩尔质量大于Cu,故乙池溶液总质量增大,故C正确;
D.甲池中的Zn2+通过阳离子交换膜进入乙池,以保持溶液电荷守恒,乙池消耗铜,溶液质量增大,故D正确,
故答案为:CD;
(3)氢氧燃料电池无论是酸性还是碱式性,其电池总反应均为:2H2+O2=2H2O ①,酸性氢氧燃料电池负极电极反应式为:2H2-4e-=4H+②,用(①-②)即得酸性氢氧燃料电池的正极反应:O2+4H++4e-=2H2O,溶液体积增大,氢离子浓度减小,pH增大,
故答案为:O2+4e-+4H+=2H2O;变大;
Ⅱ(4)碳酸酸性比次氯酸强,二氧化碳与次氯酸钙反应生成碳酸钙和次氯酸,反应的离子方程式为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,生成次氯酸不稳定,见光易分解,发生2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,洁厕剂主要成分为盐酸,与次氯酸钙反应生成氯化钙和氯气,反应的离子方程式为ClO-+Cl-+2H+=Cl2↑+H2O,
故答案为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑;ClO-+Cl-+2H+=Cl2↑+H2O;
(5)在氢氧化钾溶液中用次氯酸钠氧化氢氧化铁,生成高铁酸钾,反应的离子方程式为2Fe(OH)3+3ClO-+4OH-=3Cl-+2FeO42-+5H2O,
故答案为:2Fe(OH)3+3ClO-+4OH-=3Cl-+2FeO42-+5H2O;
(6)由总方程式可知负极锌被氧化生成氧化锌,电极方程式为Zn-2e-+2OH-=ZnO+H2O,
故答案为:Zn-2e-+2OH-=ZnO+H2O.
点评 本题综合考查对电化学以及元素化合物知识,为高考常见题型和高频考点,侧重于学生的分析能力和元素化合物知识的理解和运用的考查,注意把握物质的性质和应用,注意相关基础知识的积累,把握原电池、电解池的工作原理,难度中等.

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案| A. | 原子及其离子的核外电子层数等于该元素所在的周期数 | |
| B. | 元素周期表中从 IIIB 族到 IIB 族 10 个纵行的元素都是金属元素 | |
| C. | 第ⅠA 族元素的金属性比第ⅡA 族元素的金属性强 | |
| D. | 在周期表里,主族元素所在的族序数等于原子核外电子数 |
| A. | Na2O2投入水中 | B. | 铜片投入到FeCl3溶液中 | ||
| C. | NaHCO3溶液和NaOH溶液混合 | D. | 过量氨水加入到AlCl3溶液 |
| A. | 石油的裂化 | B. | 氯水使有色布条褪色 | ||
| C. | 活性炭使红墨水褪色 | D. | 石油的分馏 |
 微生物燃料电池是利用微生物作为反应主体,将有机物的化学能转化为电能.如以葡萄糖溶液为例,其工作原理如图所示:
微生物燃料电池是利用微生物作为反应主体,将有机物的化学能转化为电能.如以葡萄糖溶液为例,其工作原理如图所示: 尿素(H2NCONH2)是一种非常重要的高氮化肥,同时也具有重要的工业用途.
尿素(H2NCONH2)是一种非常重要的高氮化肥,同时也具有重要的工业用途.