题目内容
14.用无机矿物资源生产部分材料,其生产流程如图.下列有关说法不正确的是( )
| A. | Al2O3、SiCl4均为共价化合物 | |
| B. | 生产过程中均涉及氧化还原反应 | |
| C. | 石英可用于制光导纤维,晶体Si常用做半导体材料 | |
| D. | 黄铜矿冶炼铜时产生的SO2可用于生产硫酸,FeO可用于冶炼铁 |
分析 A.氧化铝属于离子化合物;
B.存在元素化合价的变化的反应属于氧化还原反应;
C.根据硅的单质和化合物的应用分析;
D.SO2可以转化成SO3,进而生成H2SO4;FeO与CO在高温下可生成Fe.
解答 解:A.SiCl4为共价化合物,氧化铝是由铝离子与氧离子构成的,属于离子化合物,故A错误;
B.由氧化铝生产Al时,Al的化合价发生变化,黄铜矿制备Cu时,Cu的化合价发生变化,石英与C反应生成Si时,Si元素的化合价发生变化,所以均是氧化还原反应,故B正确;
C.石英可用于制光导纤维,晶体Si的导电性介于导体与绝缘体之间,常用做半导体材料,故C正确;
D.SO2可以转化成SO3,进而生成H2SO4;FeO与CO在高温下可生成Fe,故D正确.
故选A.
点评 本题综合考查元素化合物知识,重于元素化合物的性质和应用、金属的冶炼的考查,注意把握物质的性质以及反应原理,难度不大

练习册系列答案
相关题目
4.下列说法或表示法正确的是( )
| A. | 1 mol H2SO4与1 mol Ba(OH)2完全中和所放出的热量为中和热 | |
| B. | 由C(石墨)→C(金刚石)△H=+119 kJ•mol-1可知,石墨比金刚石稳定 | |
| C. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=+285.8 kJ•mol-1 | |
| D. | 在101 kPa,298 K条件下,1 mol S和2 mol S的燃烧热相等 |
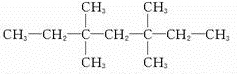
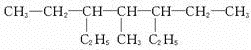
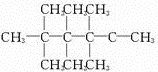
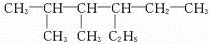
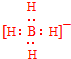 ;V的氢氧化物作弱酸时有类似TR4-的离子产生,其电离方程式为Al(OH)3+H2O?H++[Al(OH)4]-.
;V的氢氧化物作弱酸时有类似TR4-的离子产生,其电离方程式为Al(OH)3+H2O?H++[Al(OH)4]-.