题目内容
铁是人类较早使用的金属之一.运用铁及其化合物的知识,完成下列各题.
(1)下列所含铁元素既有氧化性又有还原性的物质是 (用字母代号填).
A.Fe B. FeCl3 C.FeSO4 D.Fe2O3
(2)向沸水中逐滴滴加1mol?L-1FeCl3溶液,至液体呈透明的红褐色,该分散系中微粒直径的范围是 nm.检验这种透明的红褐色液体是否胶体,其方法(或操作)是看该液体是否具有 .
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板.
①请写出FeCl3溶液与铜反应的化学方程式: .
②从使用过的腐蚀废液中回收铜,并能重新获得FeCl3溶液.步骤如下:
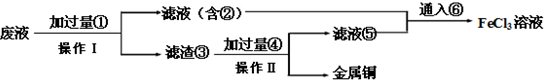
a.实验室中进行操作Ⅰ、Ⅱ所用的主要仪器是 .
b.所加的过量的①、④的名称(或化学式)分别是 ;写出滤液通入⑥所发生反应的离子方程式: .
(1)下列所含铁元素既有氧化性又有还原性的物质是
A.Fe B. FeCl3 C.FeSO4 D.Fe2O3
(2)向沸水中逐滴滴加1mol?L-1FeCl3溶液,至液体呈透明的红褐色,该分散系中微粒直径的范围是
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板.
①请写出FeCl3溶液与铜反应的化学方程式:
②从使用过的腐蚀废液中回收铜,并能重新获得FeCl3溶液.步骤如下:

a.实验室中进行操作Ⅰ、Ⅱ所用的主要仪器是
b.所加的过量的①、④的名称(或化学式)分别是
考点:铁的化学性质,金属的回收与环境、资源保护
专题:元素及其化合物
分析:(1)根据铁的三种价态0、+2、+3之间的转化关系来解题,其中0价铁只有还原性,+2价铁既有氧化性又有还原性,+3价铁质具有氧化性;
(2)根据向沸水中逐滴滴加饱和FeCl3溶液生成氢氧化铁胶体,根据胶体分析;
(3)①铜与氯化铁反应生成氯化铁、氯化亚铁;检验溶液中Fe3+存在通常用KSCN溶液,溶液变红说明Fe3+存在;
②反应中含有氯化亚铁、氯化铜,由工艺流程可知,滤渣③中含有金属铜,故应是废液与过量的Fe反应,滤液②中含有氯化亚铁,通入氯气可以得到氯化铁.滤渣③中含有金属铜、未反应的铁,加入盐酸,过滤,回收铜,滤液⑤中含有氯化亚铁,与滤液②合并,制备氯化铁以此分析.
(2)根据向沸水中逐滴滴加饱和FeCl3溶液生成氢氧化铁胶体,根据胶体分析;
(3)①铜与氯化铁反应生成氯化铁、氯化亚铁;检验溶液中Fe3+存在通常用KSCN溶液,溶液变红说明Fe3+存在;
②反应中含有氯化亚铁、氯化铜,由工艺流程可知,滤渣③中含有金属铜,故应是废液与过量的Fe反应,滤液②中含有氯化亚铁,通入氯气可以得到氯化铁.滤渣③中含有金属铜、未反应的铁,加入盐酸,过滤,回收铜,滤液⑤中含有氯化亚铁,与滤液②合并,制备氯化铁以此分析.
解答:
解:(1)铁的三种价态为0、+2、+3,+2价铁既有氧化性又有还原性,所以FeSO4既有氧化性又有还原性,故答案为:C;
(2)向沸水中逐滴滴加饱和FeCl3溶液,至液体呈透明的红褐色,生成氢氧化铁胶体,胶体的微粒直径的范围是1~100nm,胶体可以通过丁达尔现象(效应)
来检验;故答案为:1~100;丁达尔现象(效应);
(3)①铜与氯化铁反应生成氯化铁、氯化亚铁,反应方程式为:2FeCl3+Cu═2 FeCl2+CuCl2,故答案为:2FeCl3+Cu═2 FeCl2+CuCl2;
②由工艺流程可知,操作Ⅰ过滤得滤渣③中含有金属铜,目的是制取氯化铁,废液应该与铁过量的Fe反应,故①Fe;滤液②中含有FeCl2,通入⑥氯气可以得到氯化铁;滤渣③中含有金属Cu、未反应的Fe,加入④盐酸,过滤,回收铜,滤液⑤中含有FeCl2,与滤液②合并,制备氯化铁,由上述分析可知:①Fe ④HCl
a.通过以上分析知,实验室中进行操作Ⅰ、Ⅱ都是过滤,所用的主要仪器为:铁架台、烧杯、玻璃棒、漏斗;故答案为:铁架台、烧杯、玻璃棒、漏斗;
b.通过以上分析知,①Fe、④HCl,氯水将氯化铁氧化生成氯化铁,离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:Fe;HCl;2Fe2++Cl2=2Fe3++2Cl-.
(2)向沸水中逐滴滴加饱和FeCl3溶液,至液体呈透明的红褐色,生成氢氧化铁胶体,胶体的微粒直径的范围是1~100nm,胶体可以通过丁达尔现象(效应)
来检验;故答案为:1~100;丁达尔现象(效应);
(3)①铜与氯化铁反应生成氯化铁、氯化亚铁,反应方程式为:2FeCl3+Cu═2 FeCl2+CuCl2,故答案为:2FeCl3+Cu═2 FeCl2+CuCl2;
②由工艺流程可知,操作Ⅰ过滤得滤渣③中含有金属铜,目的是制取氯化铁,废液应该与铁过量的Fe反应,故①Fe;滤液②中含有FeCl2,通入⑥氯气可以得到氯化铁;滤渣③中含有金属Cu、未反应的Fe,加入④盐酸,过滤,回收铜,滤液⑤中含有FeCl2,与滤液②合并,制备氯化铁,由上述分析可知:①Fe ④HCl
a.通过以上分析知,实验室中进行操作Ⅰ、Ⅱ都是过滤,所用的主要仪器为:铁架台、烧杯、玻璃棒、漏斗;故答案为:铁架台、烧杯、玻璃棒、漏斗;
b.通过以上分析知,①Fe、④HCl,氯水将氯化铁氧化生成氯化铁,离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:Fe;HCl;2Fe2++Cl2=2Fe3++2Cl-.
点评:本题考查较综合,涉及物质的分离和提纯、氧化还原反应、胶体等知识点,明确物质的性质是解本题关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法中,不正确的是( )
| A、利用焰色反应可鉴别KC1溶液和NaCl溶液 |
| B、利用丁达尔效应可鉴别溶液和胶体 |
| C、运用过滤的方法,可以分离泥沙和氯化钠溶液混合物 |
| D、用pH试纸测定某溶液的pH时,需预先用蒸馏水湿润pH试纸 |
下列物质分离提纯的方法不正确的是( )
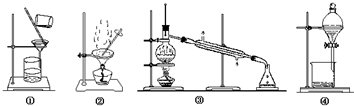

| A、提纯含杂质的工业酒精选择装置③ |
| B、提纯含杂质的粗苯甲酸选择装置①② |
| C、从溴水中提纯溴选择装置④ |
| D、苯中混有少量苯酚选择装置④ |
FeCl2溶液呈浅绿色,其中存在着下列平衡:Fe2++2H2O?Fe(OH)2+2H+往该溶液中滴加盐酸,发生的变化是( )
| A、溶液的颜色逐渐变浅 |
| B、平衡向正反应方向移动 |
| C、溶液由浅绿色变成黄色 |
| D、平衡向逆反应方向移动 |
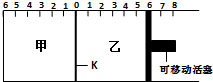 如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g),反应达到平衡后,恢复到反应发生前的温度.下列有关说法正确的是( )
如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g),反应达到平衡后,恢复到反应发生前的温度.下列有关说法正确的是( )| A、根据隔板K滑动与否不能判断左右两边的反应是否达到平衡 |
| B、若平衡时K停留在左侧1处,则活塞仍停留在右侧6处 |
| C、到达平衡时,甲容器中C的物质的量等于乙容器中C的物质的量 |
| D、达到平衡后,隔板K最终停留在左侧刻度0--2之间 |
R、X、Y和Z四种元素,它们常见的化合价均为+2价,且X2+与单质R不反应;X2++Z═X+Z2+;Y+Z2+═Y2++Z.这四种离子被还原成0价时,表现的氧化性强弱顺序正确的是( )
| A、R2+>X2+>Z2+>Y2+ |
| B、X2+>R2+>Y2+>Z2+ |
| C、Y2+>Z2+>R2+>X2+ |
| D、Z2+>X2+>R2+>Y2+ |
化学式为C5H10的链状烃有(考虑顺反异构体)( )
| A、3种 | B、4种 | C、5种 | D、6种 |
H+(aq)+OH-(aq)=H2O(l)△H=a,则a可能等于( )
| A、-57.3mol/L |
| B、-57.3kJ/mol |
| C、+57.3J/mol |
| D、-57.3J/mol |
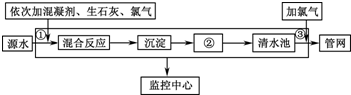 如图是目前我国城市饮用水的生产流程,生活饮用水水质的标准主要有:色度、浑浊度、pH、细菌总数、气味等.
如图是目前我国城市饮用水的生产流程,生活饮用水水质的标准主要有:色度、浑浊度、pH、细菌总数、气味等.