题目内容
NA表示阿伏伽德罗常数,下列判断正确的是( )
A、16g CH4与18 g NH
| ||
| B、7.8gNa2O2与足量的CO2反应时转移的电子数为0.1NA | ||
| C、1 mol Cl2参加反应转移电子数一定为2 NA | ||
| D、含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol?L-1 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、根据n=
并结合质子数的个数来计算;
B、Na2O2与足量的CO2的反应是歧化反应;
C、Cl2参加反应可能为歧化反应;
D、Na2O溶解于1L水后,导致溶液的体积不再是1L.
| m |
| M |
B、Na2O2与足量的CO2的反应是歧化反应;
C、Cl2参加反应可能为歧化反应;
D、Na2O溶解于1L水后,导致溶液的体积不再是1L.
解答:
解:A、16CH4的物质的量n=
=
=1mol,而1molCH4含10mol质子,故16CH4含有10mol质子;18 g NH
物质的量n=
=
=1mol,1mol NH
含有11mol电子,故18 g NH
含有11mol电子,故A错误;
B、Na2O2与足量的CO2的反应是歧化反应:2Na2O2+2CO2=2Na2CO3+O2↑1molNa2O2转移1mol电子,故7.8gNa2O2即0.1molNa2O2转移0.1mol电子,个数为0.1NA,故B正确;
C、Cl2参加反应可能为本身的歧化反应,如2Na2O2+2CO2=2Na2CO3+O2↑,故1 mol Cl2参加反应转移电子数不一定为2NA,还可能为NA,故C错误;
D、Na2O溶解于1L水后,导致溶液的体积不再是1L,故Na+的物质的量浓度不是1mol?L-1,故D错误.
故选B.
| m |
| M |
| 16g |
| 16g/mol |
+ 4 |
| m |
| M |
| 18g |
| 18g/mol |
+ 4 |
+ 4 |
B、Na2O2与足量的CO2的反应是歧化反应:2Na2O2+2CO2=2Na2CO3+O2↑1molNa2O2转移1mol电子,故7.8gNa2O2即0.1molNa2O2转移0.1mol电子,个数为0.1NA,故B正确;
C、Cl2参加反应可能为本身的歧化反应,如2Na2O2+2CO2=2Na2CO3+O2↑,故1 mol Cl2参加反应转移电子数不一定为2NA,还可能为NA,故C错误;
D、Na2O溶解于1L水后,导致溶液的体积不再是1L,故Na+的物质的量浓度不是1mol?L-1,故D错误.
故选B.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题的关键.难度不大.

练习册系列答案
相关题目
下列各组物质中,所含分子数一定相同的是( )
| A、2g H2和16 g O2 |
| B、0.1molHCl和2.24LAr |
| C、150℃、1.01×105 Pa时,1L CO2和1LH2O |
| D、28g CO和6.02×1022个O3 |
下列物质中,不属于卤代烃的是( )
| A、氯乙烯 | B、溴苯 |
| C、四氯化碳 | D、硝基苯 |
0.2mol有机物和0.4mol O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g).产物经过浓硫酸后,浓硫酸的质量增加10.8g;再通过灼热CuO充分反应后,固体质量减轻3.2g;最后气体再通过碱石灰被完全吸收,碱石灰质量增加17.6g.0.1mol该有机物恰好与4.6g金属钠完全反应.下列关于该有机物的说法不正确的是( )
| A、该化合物的相对分子质量是62 |
| B、该化合物的化学式为C2H6O2 |
| C、1 mol该化合物能与2 mol O2发生催化氧化反应 |
| D、1 mol该有机物最多能与2 mol Na反应 |
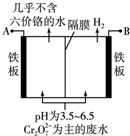 某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,工业设备如图所示,下列说法正确的是( )
某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,工业设备如图所示,下列说法正确的是( )| A、A接电源负极 |
| B、阳极区溶液中发生的氧化还原反应为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O |
| C、阴极区附近溶液pH降低 |
| D、若不考虑气体的溶解,当收集到H213.44L(标准状况)时,有0.2mol Cr2O72-被还原 |
下列说法正确的是( )
| A、分子式为C5H12的一氯代物可能有6种结构 |
| B、油脂的种类很多,但它们水解后都有一种相同产物 |
| C、相同物质的量的乙烯和乙醇完全燃烧,乙醇消耗氧气的物质的量更多 |
| D、蚕丝与蜡烛主要成分均为烃类物质 |
下列试剂的保存或使用正确的是( )
| A、实验室的氯水需要保存在棕色试剂瓶中 |
| B、漂白粉比氯水稳定,可露置在空气中 |
| C、称量氢氧化钠固体时,可在天平两个托盘上各放一张等质量的纸,左边纸上放NaOH,右边纸上放砝码 |
| D、金属钠可保存在煤油、四氯化碳等有机溶剂中 |
下列说法正确的是( )
| A、实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取 |
| B、用乙醇和浓硫酸制备乙烯时,可用水浴加热控制反应的温度 |
| C、石油的分馏是物理变化,而煤的干馏是化学变化 |
| D、将(NH4)2SO4、CuSO4溶液分别加入蛋白质溶液,都出现沉淀,表明二者均可使蛋白质变性 |