题目内容
16.(1)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.
①在不同温度下催化剂的催化效率与乙酸的生成速率如图1所示,250-300℃时,温度升高而乙酸的生成速率降低的主要原因是温度超过250℃时,催化剂的催化效率降低.
②将Cu2Al2O4溶解在稀硝酸中的离子方程式为3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
③电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图如图2(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).电解时,阳极的电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O.
(2)将甲烷和硫反应可以制备CS2,其流程如图3所示:
①反应1产生两种含硫的物质,则该反应方程式为CH4+4S→CS2+2H2S.
②为了提高CS2产率,设计反应2和3实现硫单质循环利用,实验时需对反应1出来的气体分流,则进入反应2和反应3的气体物质的量之比为2:1.
③当反应1中每有1molCS2生成时,反应2中需要消耗O2的物质的量为3mol.
分析 (1)①由图可知,该催化剂在250℃左右时催化剂效率最高;
②先将Cu2Al2O4拆成氧化物的形式:Cu2O•Al2O3,再根据氧化物与酸反应生成离子方程式,需要注意的是一价铜具有还原性;
③根据图2可知:该电池反应时中,氮元素化合价由-3价变为0价,H元素化合价由+1价变为0价,所以生成氮气的电极是阳极,阳极上尿素失电子和氢氧根离子反应生成碳酸根离子、氮气和水;生成氢气的电极是阴极;
(2)甲烷和硫反应可以制备CS2,其流程:甲烷和硫反应:CH4+4S→CS2+2H2S,分离得到CS2,为了提高CS2产率,设计反应2和3实现硫单质循环利用,
反应2为:2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O,反应3为2H2S+SO2=3S+2H2O.
①根据题干信息反应1产生两种含硫的物质为二硫化碳和硫化氢;
②根据反应3为2H2S+SO2=3S+2H2O分析;
③当反应1中每有1molCS2生成时,反应2中有2molH2S参加反应.
解答 解:(1)①由图可知,该催化剂在250℃左右时催化剂效率最高,温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低,
故答案:温度超过250℃时,催化剂的催化效率降低;
②Cu2Al2O4拆成氧化物的形式:Cu2O•Al2O3,与酸反应生成离子方程式:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O,
故答案为:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O;
③由图可知,CO(NH2)2在阳极放电生成N2,C元素价态未变化,故还有碳酸钾生成与水生成;阳极上尿素失电子和氢氧根离子反应生成碳酸根离子、氮气和水,电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O,阴极上水得电子生成氢气和氢氧根离子,电极反应式为2H2O+2e-═H2↑+2OH-,
故答案为:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O;
(2)甲烷和硫反应可以制备CS2,反应1:CH4+4S→CS2+2H2S,反应2为:2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O,反应3为2H2S+SO2=3S+2H2O.
①反应1产生两种含硫的物质,可理解为甲烷高温分解生成碳和氢气,碳和硫反应生成二硫化碳、氢气和硫反应生成硫化氢,所以反应1为:CH4+4S→CS2+2H2S,
故答案为:CH4+4S→CS2+2H2S;
②为了提高CS2产率,设计反应2和3实现硫单质循环利用,即通过反应3恰当配比实现硫单质循环利用,反应3为2H2S+SO2=3S+2H2O,所以进入反应2为H2S,反应3的气体为硫化氢燃烧生成的二氧化硫,两者物质的量之比为2:1,
故答案为:2:1;
③反应1:CH4+4S→CS2+2H2S,当反应1中每有1molCS2生成时,反应2中有2molH2S参加反应,2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O,需3mol氧气,
故答案为:3mol.
点评 本题考查乙酸、CS2制备,涉及反应条件的分析应用,电解池原理的分析,电极反应书写、硫及其化合物的性质,掌握基础是关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)═Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)═3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq)?Na2S2O3(aq) (Ⅲ)
已知:Na2S2O3•5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液.
(1)写出Na2S2O3溶液和稀盐酸反应的离子方程式S2O32-+2H+=SO2↑+S↓+H2O.
(2)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若一段时间后液注高度不变,则整个装置气密性良好,装置E的作用是吸收多余的气体,防止污染空气.
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择c.
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中,已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是淡黄色沉淀完全消失.
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩、冷却结晶即可析出Na2S2O3•5H2O,其中可能含有Na2SO3、Na2SO4等杂质.为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量产品加适量蒸馏水配成稀溶液,滴加足量BaCl2溶液. | |
| 步骤2: |
| A. | NH4+、Cu2+、Cl-、NO3- | B. | K+、Fe3+、OH-、SCN- | ||
| C. | Ag+、NO3-、Cl-、K+ | D. | Na+、CH3COO-、H+、OH- |
| A. | NaHCO3═Na++H++CO32- | B. | Na2HPO4?2Na++HPO42- | ||
| C. | NH4++2H2O?NH3•H2O+H3O+ | D. | C(s)+O2(g)═CO2(g)△H=+393.5 kJ•mol-1 |
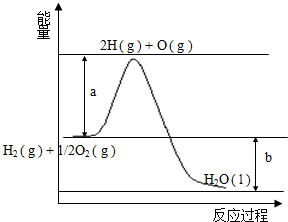 已知H2的燃烧热为285.8kJ•mol-1,反应过程中能量变化如图:请回答下列问题:
已知H2的燃烧热为285.8kJ•mol-1,反应过程中能量变化如图:请回答下列问题: