题目内容
下列溶液,一定呈中性的是( )
| A、c(H+)=1×10-7mol/L的溶液 |
| B、c(H+)=c(OH) 的溶液 |
| C、强酸与强碱等物质的量混合后的溶液 |
| D、由等体积、等物质的量浓度的一元酸跟氢氧化钠溶液混合后所形成的溶液 |
考点:水的电离
专题:电离平衡与溶液的pH专题
分析:溶液的酸碱性是根据溶液中氢离子浓度和氢氧根离子浓度的相对大小判断的,当溶液中c(H+)>c(OH-)时,溶液呈酸性;当c(H+)=c(OH-)时,溶液呈中性;当溶液中c(H+)<c(OH-)时,溶液呈碱性,注意不能根据溶液的pH值大小判断.
解答:
解:A、c(H+)=10-7mol?L-1的溶液,溶液的pH=7,pH=7的溶液不一定呈中性,如100℃时,水的离子积常数是10-12,当PH=6时溶液呈中性,当PH=7时溶液呈碱性,故A错误.
B、满足c(H+)=c(OH-)=1×10-6mol?L-1的溶液一定为中性溶液,故B正确;
C、强酸强碱等物质的量混合后的溶液可能呈酸性、碱性、中性,酸和碱的元数不同,如二元酸和一元碱反应后溶液中剩余氢离子呈酸性,故C错误;
D、由等体积、等物质的量浓度的一元酸溶液与NaOH溶液混合后,酸如果为弱酸,则反应后溶液显示碱性,若酸为强酸,则反应后溶液为中性,故D错误;
故选B.
B、满足c(H+)=c(OH-)=1×10-6mol?L-1的溶液一定为中性溶液,故B正确;
C、强酸强碱等物质的量混合后的溶液可能呈酸性、碱性、中性,酸和碱的元数不同,如二元酸和一元碱反应后溶液中剩余氢离子呈酸性,故C错误;
D、由等体积、等物质的量浓度的一元酸溶液与NaOH溶液混合后,酸如果为弱酸,则反应后溶液显示碱性,若酸为强酸,则反应后溶液为中性,故D错误;
故选B.
点评:本题考查了水的电离、溶液pH的计算计算,题目难度中等,注意掌握溶液酸碱性的判断方法,明确溶液酸碱性取决于氢离子与氢氧根离子浓度大小.

练习册系列答案
相关题目
设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、1 mol Fe与足量H2O(g)反应,转移的电子数为2NA |
| B、10mL pH=6的纯水中含OH-数目为10-8 NA |
| C、1mol羟基中含有的电子数目为9 NA |
| D、100 mL 1 mol/L 的Na2CO3溶液中含有CO32-的数目为0.1NA |
下列说法中正确的是( )
| A、1mol/L的NaCl溶液是指由1mol NaCl和1000mL水配制成的溶液 |
| B、从1L 0.5 mol/L的NaCl溶液中取出100mL,剩余溶液物质的量浓度为0.45 mol/L |
| C、0℃时,2mol Cl2的体积可能为22.4L |
| D、CaCl2的摩尔质量是111g |
下列有关金属的描述,正确的是( )
| A、Cu和S在加热的条件下反应可生成CuS |
| B、金属铁和铝都可以被浓硫酸钝化,因此铁和铝都不能与浓硫酸反应 |
| C、等质量的金属铝,分别和足量的稀硫酸和氢氧化钠溶液反应,所得氢气一样多 |
| D、除去镀在铝表面的铜镀层,最佳试剂是稀硝酸 |
常温下,下列有关离子浓度及pH大小的比较,正确的是( )
| A、NH4+ 浓度相同的下列溶液:①(NH4) 2 Fe(SO4)2②(NH4) 2 CO3③(NH4) 2SO4,溶液浓度由大到小的顺序是:③>②>① |
| B、由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,其离子浓度不可能是:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| C、pH=13的Ba(OH)2溶液与pH=1的HCl溶液等体积混合后,混合溶液的pH>7 |
| D、pH=12的Ba(OH)2溶液与pH=14的NaOH溶液等体积混合,混合溶液的pH范围是13<pH<14 |
下列有关化学用语表示正确的是( )
A、钾离子结构示意图: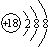 | ||
| B、乙醇的分子式:CH3CH2OH | ||
C、水合氢离子电子式: | ||
D、中子数为18的硫原子:
|
 ”(“→”表示一步反应)的是( )
”(“→”表示一步反应)的是( )