题目内容
已知酸性: >H2CO3>
>H2CO3> ,将
,将 转变为
转变为 的方法为:( )
的方法为:( )
①与足量的NaOH溶液共热后,再通入CO2
②与足量的NaOH溶液共热后,通入足量的稀盐酸
③与稀H2SO4共热后,加入足量的NaHCO3饱和溶液
④与稀H2SO4共热后,加入足量的NaOH溶液.
 >H2CO3>
>H2CO3> ,将
,将 转变为
转变为 的方法为:( )
的方法为:( )①与足量的NaOH溶液共热后,再通入CO2
②与足量的NaOH溶液共热后,通入足量的稀盐酸
③与稀H2SO4共热后,加入足量的NaHCO3饱和溶液
④与稀H2SO4共热后,加入足量的NaOH溶液.
| A、只有① | B、①② |
| C、①③ | D、①③④ |
考点:有机物的结构和性质
专题:有机物的化学性质及推断
分析:要将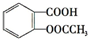 转化为
转化为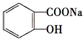 ,先发生水解得到邻羟基苯甲酸,再与足量的NaHCO3溶液反应即可,以此来解答.
,先发生水解得到邻羟基苯甲酸,再与足量的NaHCO3溶液反应即可,以此来解答.
 转化为
转化为 ,先发生水解得到邻羟基苯甲酸,再与足量的NaHCO3溶液反应即可,以此来解答.
,先发生水解得到邻羟基苯甲酸,再与足量的NaHCO3溶液反应即可,以此来解答.解答:
解:①与足量NaOH溶液共热,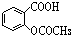 与氢氧化钠溶液反应生成
与氢氧化钠溶液反应生成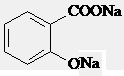 ,再通入足量CO2,由于酸性
,再通入足量CO2,由于酸性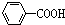 >H2CO3>
>H2CO3>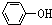 >HCO3-,所以二氧化碳与
>HCO3-,所以二氧化碳与 反应生成
反应生成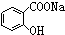 ,故正确;
,故正确;
②与足量的NaOH溶液共热后,水解生成 ,再加入足量氯化氢,生成
,再加入足量氯化氢,生成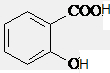 ,得不到
,得不到 ,故错误;
,故错误;
③ ,则可实现转化,故正确;
,则可实现转化,故正确;
④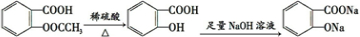 ,则不能转化为邻羟基苯甲酸钠,故错误;
,则不能转化为邻羟基苯甲酸钠,故错误;
故选C.
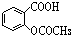 与氢氧化钠溶液反应生成
与氢氧化钠溶液反应生成 ,再通入足量CO2,由于酸性
,再通入足量CO2,由于酸性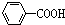 >H2CO3>
>H2CO3>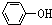 >HCO3-,所以二氧化碳与
>HCO3-,所以二氧化碳与 反应生成
反应生成 ,故正确;
,故正确;②与足量的NaOH溶液共热后,水解生成
 ,再加入足量氯化氢,生成
,再加入足量氯化氢,生成 ,得不到
,得不到 ,故错误;
,故错误;③
 ,则可实现转化,故正确;
,则可实现转化,故正确;④
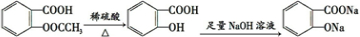 ,则不能转化为邻羟基苯甲酸钠,故错误;
,则不能转化为邻羟基苯甲酸钠,故错误;故选C.
点评:本题考查有机物的合成及结构与性质,为高频考点,把握有机物官能团与性质的关系、强酸制取弱酸的反应原理为解答的关键,注意合成有机反应中酚-OH与碳酸氢钠不反应,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在碱性溶液中能大量共存且溶液为无色透明的离子组是( )
| A、K+、MnO4-、Na+、Cl- |
| B、K+、Na+、NO3-、CO32- |
| C、Na+、H+、NO3-、SO42- |
| D、Ca2+、Na+、Cl-、HCO3- |
胶体溶液和普通溶液的本质区别是( )
| A、胶体溶液的粒子直径在10-9m~10-7m之间,而普通溶液的粒子直径大于10-7m |
| B、胶体溶液的粒子不能透过半透膜,而普通溶液的粒子能透过半透膜 |
| C、胶体溶液有丁达尔效应,而普通溶液则没有 |
| D、胶体溶液不稳定,而普通溶液稳定 |
正确的存放化学药品,是化学实验基本要求之一.下列物质存放错误的是( )
| A、漂白粉长期敞口放置于广口瓶中 |
| B、金属钠存放于煤油中 |
| C、水玻璃盛放在带橡皮塞的试剂瓶中 |
| D、浓硝酸存放在棕色试剂瓶中 |
下到实验不能证明HR为弱酸的是( )
| A、室温下,NaR溶液的pH大于7 |
| B、加热NaR溶液时,溶液的pH变小 |
| C、将锌粒分别投入到1 mol?L-1的盐酸和HR中,HR产生氢气的速率慢 |
| D、室温下,0.1 mol?L-1HR的pH>1 |
