题目内容
17.下列关于物质的分类正确的是( )| A. | 酸性氧化物:SO2 Mn2O7 NO | |
| B. | 碱性氧化物:Na2O Na2O2 Al2O3 | |
| C. | 盐:Na2CO3 AlCl3 AgCl | |
| D. | 电解质:SO3 Na2O BaSO4 |
分析 A.酸性氧化物是指和碱反应生成盐和水的氧化物,反应为复分解反应;
B.碱性氧化物是指和酸反应生成盐和水的氧化物,反应为复分解反应;
C.金属离子或铵根离子与酸根离子构成的化合物为盐;
D.水溶液中或熔融状态下导电的化合物为电解质;
解答 解:A.SO2、Mn2O7和碱反应生成盐和水属于酸性氧化物,NO和碱不反应属于不成盐氧化物,故A错误;
B.Na2O和酸反应生成盐和水属于碱性氧化物,Na2O2和酸反应生成盐、水和氧气,发生的是氧化还原反应,不是碱性氧化物,属于过氧化物,Al2O3 和酸碱都能反应生成盐和水,属于两性氧化物,故B错误;
C.Na2CO3、AlCl3、AgCl都是金属阳离子和酸根阴离子构成的化合物属于盐类,故C正确;
D.SO3自身不能电离出离子,属于非电解质,Na2O和BaSO4熔融状态下都能导电属于电解质,故D错误;
故选C.
点评 本题考查了物质分类、物质组成和性质、主要是氧化物、盐、电解质等概念的实质理解,掌握基础是解题关键,题目难度不大.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
7.下列现象与形成配合物无关的是( )
| A. | 向FeCl3中滴入KSCN,出现红色 | |
| B. | 向Cu与Cl2反应后的集气瓶中加少量H2O,呈绿色,再加水,呈蓝色 | |
| C. | Cu与浓硝酸反应后,溶液呈绿色;Cu与稀硝酸反应后,溶液呈蓝色 | |
| D. | 向AlCl3中逐滴滴加NaOH至过量,先出现白色沉淀,继而消失 |
8.从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4下列说法正确的是( )
| A. | Cu2S是还原产物,反应中1 mol CuSO4失1 mol电子 | |
| B. | 5 mol FeS2发生反应,有10 mol电子转移 | |
| C. | 产物中的SO42-离子有一部分是氧化产物 | |
| D. | FeS2只作还原剂 |
9.一定条件下,浓度都是1mol•L-1的两种气体X2和Y2,在密闭容器中反应,生成气体Z,4s后,X2、Y2、Z的浓度分别是0.4mol•L-1、0.8mol•L-1、0.4mol•L-1,若用X、Y表示Z的化学式,该反应的化学方程式为( )
| A. | 3X2+Y2═2X3Y | B. | 2X2+Y2═2X2Y | C. | X2+2Y2═2XY2 | D. | X2+3Y2═2XY3 |
6.在使紫色石蕊试剂变红的溶液中,能大量共存的离子是( )
| A. | Mg2+、Fe2+、SO42-、Cl- | B. | Al3+、Fe3+、I-、SO42- | ||
| C. | K+、Na+、Cl-、HCO3- | D. | Na+、Ba2+、NO3-、SO42- |
7.某无色溶液,由Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的若干种组成.取该溶液进行如下实验:
(1)取适量溶液,加入过量盐酸,有气体生成,并得到无色溶液;
(2)在(1)所得溶液中加入过量NH4HCO3溶液,有气体生成,同时析出白色沉淀甲;
(3)在(2)所得溶液中加入过量Ba(OH)2溶液也有气体生成,同时析出白色沉淀乙.
则下列离子在原溶液中一定存在的有( )
(1)取适量溶液,加入过量盐酸,有气体生成,并得到无色溶液;
(2)在(1)所得溶液中加入过量NH4HCO3溶液,有气体生成,同时析出白色沉淀甲;
(3)在(2)所得溶液中加入过量Ba(OH)2溶液也有气体生成,同时析出白色沉淀乙.
则下列离子在原溶液中一定存在的有( )
| A. | SO42-、AlO2-、Na+ | B. | Na+、CO32-、AlO2- | C. | CO32-、Na+、Al3+ | D. | MnO4-、Na+、CO32- |
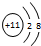 ,F中的化学键为离子键、共价键;
,F中的化学键为离子键、共价键;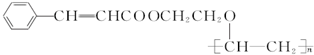 .按如图所示关系可以合成甲,其中试剂I可由乙醇与氧气在催化剂加热条件下反应得到.
.按如图所示关系可以合成甲,其中试剂I可由乙醇与氧气在催化剂加热条件下反应得到.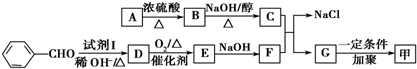
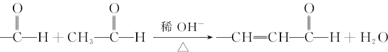
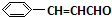 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2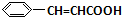 +H2O;
+H2O;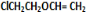 +
+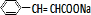 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$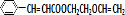 +NaCl.
+NaCl.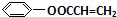 .
.