题目内容
真空碳热还原氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g)△H=akJ?mol-1
3AlCl(g)═2Al(l)+AlCl3(g)△H=bkJ?mol-1
反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H= kJ?mol-1(用含a、b的代数式表示).
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g)△H=akJ?mol-1
3AlCl(g)═2Al(l)+AlCl3(g)△H=bkJ?mol-1
反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=
考点:用盖斯定律进行有关反应热的计算
专题:化学反应中的能量变化
分析:根据盖斯定律,将题中所给两方程式相加得Al2O3(s)+3C(s)=2Al(l)+3CO(g).
解答:
解:已知:①Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g)△H=akJ?mol-1
②3AlCl(g)═2Al(l)+AlCl3(g)△H=bkJ?mol-1
根据盖斯定律,①+②得Al2O3(s)+3C(s)=2Al(l)+3CO(g),对应的△H=(a+b)kJ?mol-1,
故答案为:a+b;
②3AlCl(g)═2Al(l)+AlCl3(g)△H=bkJ?mol-1
根据盖斯定律,①+②得Al2O3(s)+3C(s)=2Al(l)+3CO(g),对应的△H=(a+b)kJ?mol-1,
故答案为:a+b;
点评:本题考查化学反应与能量,侧重于盖斯定律的运用,注意把握盖斯定律的原理以及计算方法,难度不大.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、1mol[Ag (NH3)2]OH配合物中含有9NA个σ键 |
| B、标准状况下,22.4L C2H6O中含C-H键5NA |
| C、1mol冰醋酸和lmol乙醇在加热和浓硫酸条件下充分反应生成的水分子数为NA |
| D、KClO3+6HCl═KCl+3Cl2↑+3H2O反应中,生成71g Cl2时,转移的电子数目为2NA |
从某些性质看,NH3与H2O、NH
与H3O+、NH
与OH-、NH2-与O2-相似,下列有关化学方程式不正确的是( )
+ 4 |
- 2 |
| A、氯化铵与KNH2反应:NH4Cl+KNH2═KCl+2NH3↑ |
| B、二价活泼金属M与液氨反应:M+2NH3═M(NH2)2+H2↑ |
| C、盐酸与MNH反应:2HCl+MNH═MCl2+NH3↑ |
| D、氯化铵与MO反应:2NH4Cl+MO═M(NH2)2+2HCl+H2O |
2014南京青奥会,体操运动员在比赛时为了防滑.常在手掌上涂抹碳酸镁粉末,碳酸镁属于 ( )
| A、酸 | B、碱 | C、盐 | D、氧化物 |
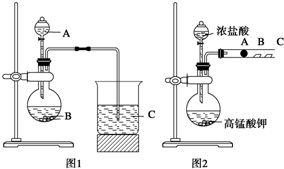 某研究性学习小组设计了一组实验来探究元素周期律.甲同学:根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;
某研究性学习小组设计了一组实验来探究元素周期律.甲同学:根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;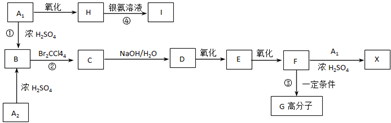
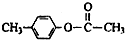 、
、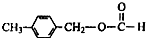 外,其余的结构简式:
外,其余的结构简式: