题目内容
17.关于一些重要的化学概念及实验有下列说法:①AgCl是一种难溶于水的电解质;
②Na2O与Na2O2都能和水反应生成NaOH,所以它们都是碱性氧化物;
③用光亮洁净的铁丝蘸取某无色溶液,在无色灯焰上灼烧时观察到黄色火焰,则该溶液中一定含Na+,一定不含K+;
④夏天混用不同品牌的墨水书写时,钢笔的笔尖容易发生堵塞与胶体丁达尔效应有关;
⑤存放FeCl2溶液的试剂瓶内加少量铁屑防氧化;
⑥盛放液溴的试剂瓶内放少量蒸馏水防止液溴挥发;
⑦实验室制Cl2、HCl和HF可用同一套装置.
其中正确的是( )
| A. | ①⑤⑥ | B. | ②⑥⑦ | C. | ①②③④⑦ | D. | ④⑤⑥ |
分析 ①常温下,AgCl在水溶解度小于0.1g;
②Na2O2为水反应生成NaOH和氧气;
③观察钾的焰色反应需要透过蓝色的钴玻璃;
④不同品牌的墨水混合,发生聚沉;
⑤FeCl2溶液易被氧化,Fe与氯化铁反应生成氯化亚铁;
⑥溴易挥发,利用水封法保存;
⑦制Cl2为固体与液体反应且加热装置,HCl和HF可利用难挥发性酸制备易挥发性酸原理.
解答 解:①常温下,AgCl在水溶解度小于0.1g,在水中存在溶解平衡,则AgCl是一种难溶于水的电解质,故正确;
②Na2O2为水反应生成NaOH和氧气,则不是碱性氧化物,故错误;
③观察钾的焰色反应需要透过蓝色的钴玻璃,由实验可知,溶液中一定含Na+,不能确定是否含K+,故错误;
④不同品牌的墨水混合,发生聚沉,则钢笔的笔尖容易发生堵塞与胶体聚沉有关,故错误;
⑤FeCl2溶液易被氧化,Fe与氯化铁反应生成氯化亚铁,则存放FeCl2溶液的试剂瓶内加少量铁屑防氧化,故正确;
⑥溴易挥发,利用水封法保存,则盛放液溴的试剂瓶内放少量蒸馏水防止液溴挥发,故正确;
⑦制Cl2为固体与液体反应且加热装置,HCl和HF可利用难挥发性酸制备易挥发性酸原理,后者不需要加热,则实验装置不同,故错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、离子检验、溶液配制、气体的制备为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,综合性较强,题目难度不大.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
7.除去CO2中混有的少量SO2气体,最好选用的试剂是( )
| A. | 澄清石灰水 | B. | 品红溶液 | C. | 溴水 | D. | 饱和NaHCO3溶液 |
8.不粘锅内壁有一薄层为聚四氟乙烯的高分子材料的涂层,使用不粘锅烧菜时不易粘锅、烧焦.下列关于聚四氟乙烯的说法正确的是( )
| A. | 不粘锅涂层为有机高分子材料,分子中含碳碳双键 | |
| B. | 聚四氟乙烯是由不饱和烃加聚得到的 | |
| C. | 聚四氯乙烯中氟的质量分数为76% | |
| D. | 聚四氟乙烯的化学活动性较强 |
5.已知卤代烃可以和钠发生反应,例如溴乙烷与钠反应为:2CH3CH2Br+2Na→CH3CH2CH2CH3+2NaBr,应用这一反应,下列所给化合物中可以与钠合成环丁烷的是( )
| A. | CH3CH2Br | B. | CH3CH2CH2CH2Br | ||
| C. | CH2Br CH2CH2Br | D. | CH2Br CH2CH2CH2Br |
12.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 22.4L O2的物质的量约为1mol | |
| B. | 标准状况下,11.2L H2O的物质的量约为1mol | |
| C. | 1mol/L的CuSO4溶液中SO42-的物质的量为1mol | |
| D. | 4.4g CO2含有的原子数为0.3NA |
2.下列表达正确的是( )
| A. | 羟基的电子式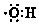 | B. | 醛基的结构简式-COH | ||
| C. | 2-丁烯的键线式  | D. | 2-丙醇的结构简式 C3H7-OH |
7.下列四组选项中,全部符合如图阴影部分的能源分类是( )


| A. | 太阳能、风能、潮汐能 | B. | 水能、生物质能、天然气 | ||
| C. | 煤炭、生物质能、沼气 | D. | 地热能、石油、核能 |
8. 1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图.下列对该实验的描述错误的是( )
1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图.下列对该实验的描述错误的是( )
 1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图.下列对该实验的描述错误的是( )
1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图.下列对该实验的描述错误的是( )| A. | 不能用水浴加热 | |
| B. | 长玻璃管起冷凝回流作用 | |
| C. | 加入过量乙酸可以提高1-丁醇的转化率 | |
| D. | 提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤 |
 某有机物由C、H、O三种元素组成,球棍模型如图所示:
某有机物由C、H、O三种元素组成,球棍模型如图所示: .
.