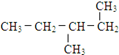题目内容
2.有机化合物A是一种农药生产的中间体,A在一定条件下可发生如图转化: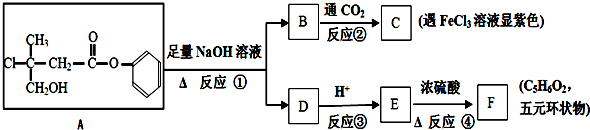
请回答下列问题:
(1)A分子中不含氧官能团的名称为氯原子.
(2)C不能发生反应的类型有b(填字母).
a.取代反应 b.消去反应 c.加成反应 d.氧化反应
(3)反应①的化学方程式为
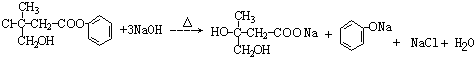 .
.(4)写出B到C的离子方程式
 +CO2+H2O→
+CO2+H2O→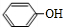 +HCO3-.
+HCO3-.(5)E在一定条件下反应能生成高分子化合物,写出此高分子化合物所有可能的结构简式:
 .
.
分析 A在碱性条件下水解生成 和
和 ,B与二氧化碳反应生成C,而C遇氯化铁溶液显紫色,故B为
,B与二氧化碳反应生成C,而C遇氯化铁溶液显紫色,故B为 ,C为
,C为 ,则D为
,则D为 ,D酸化得到E为
,D酸化得到E为 ,由E与F的分子式可知,E分子内脱去2分子水生成F,且F为五元环化合物,故E在浓硫酸作用下发生消去反应和酯化反应,F可能为
,由E与F的分子式可知,E分子内脱去2分子水生成F,且F为五元环化合物,故E在浓硫酸作用下发生消去反应和酯化反应,F可能为 、
、 、
、 ,据此解答.
,据此解答.
解答 解:A在碱性条件下水解生成 和
和 ,B与二氧化碳反应生成C,而C遇氯化铁溶液显紫色,故B为
,B与二氧化碳反应生成C,而C遇氯化铁溶液显紫色,故B为 ,C为
,C为 ,则D为
,则D为 ,D酸化得到E为
,D酸化得到E为 ,由E与F的分子式可知,E分子内脱去2分子水生成F,且F为五元环化合物,故E在浓硫酸作用下发生消去反应和酯化反应,F可能为
,由E与F的分子式可知,E分子内脱去2分子水生成F,且F为五元环化合物,故E在浓硫酸作用下发生消去反应和酯化反应,F可能为 、
、 、
、 ,
,
(1)由A分子结构可知,其不含氧官能团的名称为:氯原子,故答案为:氯原子;
(2)C为 ,可以发生取代反应、加聚反应、氧化反应,不能发生消去反应,故答案为:b;
,可以发生取代反应、加聚反应、氧化反应,不能发生消去反应,故答案为:b;
(3)反应①的化学方程式为: ,
,
故答案为: ;
;
(4)B到C的离子方程式为: +CO2+H2O→
+CO2+H2O→ +HCO3-,
+HCO3-,
故答案为: +CO2+H2O→
+CO2+H2O→ +HCO3-;
+HCO3-;
(5)E( )在一定条件下反应能生成高分子化合物,其可能的结构简式为:
)在一定条件下反应能生成高分子化合物,其可能的结构简式为: ,
,
故答案为: .
.
点评 本题考查有机物的推断,难度中等,注意根据A的结构及反应条件进行推断,需要学生熟练掌握官能团的性质与转化,难度中等.

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案
相关题目
12.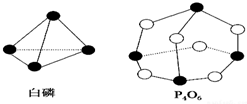 化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,若生成1mol P4O6,则反应P4(白磷)+3O2=P4O6中的能量变化为( )
化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,若生成1mol P4O6,则反应P4(白磷)+3O2=P4O6中的能量变化为( )
 化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,若生成1mol P4O6,则反应P4(白磷)+3O2=P4O6中的能量变化为( )
化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,若生成1mol P4O6,则反应P4(白磷)+3O2=P4O6中的能量变化为( )| A. | 吸收1638kJ能量 | B. | 放出1638kJ能量 | C. | 吸收126kJ能量 | D. | 放出126kJ能量 |
13.CPAE是蜂胶的主要活性成分,也可由咖啡酸合成,其合成过程如图.下列说法不正确的是 ( )


| A. | 咖啡酸分子中所有碳原子可能处在同一个平面上 | |
| B. | 可用金属Na检测上述反应是否残留苯乙醇 | |
| C. | 与苯乙醇互为同分异构体的酚类物质共6种 | |
| D. | 1molCPAE与足量的NaOH溶液反应,最多消耗3molNaOH |
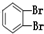
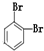
10.下列物质由CH2═CH-CH2-CH3与Br2加成得到的是( )
| A. | CH3CH2CHBrCH2Br | B. | CH3CHBrCHBrCH3 | C. | 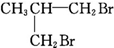 | D. | 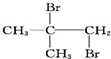 |
7.化学实验是化学学科学习、探究的基础.
(1)下列描述错误的是acde.
a.为了防止试剂瓶内的试剂被污染,取用后多余的试剂一定都不能放回原试剂瓶
b.滴定管、容量瓶、分液漏斗在使用时都需要检漏
c.海带中碘的提取时需要对干海带进行灼烧,此时需要用到的仪器有玻璃棒、燃烧匙、泥三角、三脚架、酒精灯
d.检验Na2SO3固体是否被氧化:取少量固体溶于水,加入Ba(NO3)2溶液,产生白色沉淀,滴加稀盐酸,观察白色沉淀是否溶解
e.海带中碘的提取时,对碘水中的碘进行萃取可采用裂化汽油、苯、四氯化碳、无水酒精等有机溶剂
(2)某溶液中可能存在Br-、CO32-、SO32-、I-、A13+、Mg2+、Na+等7种离子中的某几种.现取该溶液进行实验,得到如下现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,有白色沉淀生成,加入稀盐酸沉淀不溶解.
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色.据此可以推断:该溶液肯定存在的离子是:CO32-、Br-、Na+、SO32-
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:
V1=30,V6=10,V9=17.5;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因:当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与H2SO4溶液的接触面积而使反应速率下降.
(1)下列描述错误的是acde.
a.为了防止试剂瓶内的试剂被污染,取用后多余的试剂一定都不能放回原试剂瓶
b.滴定管、容量瓶、分液漏斗在使用时都需要检漏
c.海带中碘的提取时需要对干海带进行灼烧,此时需要用到的仪器有玻璃棒、燃烧匙、泥三角、三脚架、酒精灯
d.检验Na2SO3固体是否被氧化:取少量固体溶于水,加入Ba(NO3)2溶液,产生白色沉淀,滴加稀盐酸,观察白色沉淀是否溶解
e.海带中碘的提取时,对碘水中的碘进行萃取可采用裂化汽油、苯、四氯化碳、无水酒精等有机溶剂
(2)某溶液中可能存在Br-、CO32-、SO32-、I-、A13+、Mg2+、Na+等7种离子中的某几种.现取该溶液进行实验,得到如下现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,有白色沉淀生成,加入稀盐酸沉淀不溶解.
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色.据此可以推断:该溶液肯定存在的离子是:CO32-、Br-、Na+、SO32-
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
V1=30,V6=10,V9=17.5;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因:当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与H2SO4溶液的接触面积而使反应速率下降.
14.在实验室中,下列除去杂质的方法中正确的是( )
| A. | 溴苯中混有溴,加入KI溶液,振荡,用直馏汽油萃取,分液 | |
| B. | 硝基苯中混有浓硝酸,加入足量稀NaOH溶液洗涤,振荡,用分液漏斗分液 | |
| C. | 乙烯中含有SO2,将其通入装有KMnO4溶液的洗气瓶中进行洗气 | |
| D. | 乙烷中含有乙烯,通入适量的H2在一定条件下反应使乙烯转变成乙烷 |

 ⑪
⑪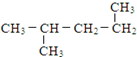 ⑫
⑫