��Ŀ����
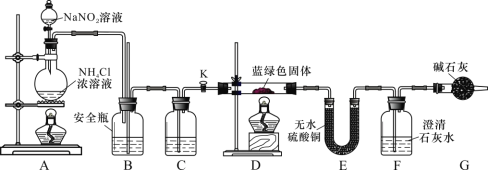
����Ŀ��ijС�����������װ�ý���ʵ�飬�ڡ�������Һ���������������������±���
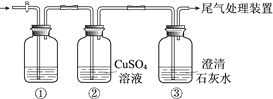
ʵ�� | ���� | ���� |
�� | ��ʢ��Na2S��Һ�Ģ��г���ͨ��CO2������ | ���в�����ɫ��������Һ��pH���ͣ� ���в�����ɫ���ǣ��û�������ð���� |
�� | ��ʢ��NaHCO3��Һ�Ģ��г���ͨ��H2S���������� | ����ͬʵ��� |
���ϣ�CaS��ˮ��ȫˮ��
������ʵ��ó��Ľ�������ȷ����
A.���а�ɫ������CaCO3
B.������ҺpH���͵�ԭ���ǣ�H2S+Cu2+ == CuS��+2H+
C.ʵ�����з����ķ�Ӧ�ǣ�CO2+H2O+ S2== CO32+ H2S
D.��ʵ���͢��ܱȽ�H2CO3��H2S���Ե�ǿ��
���𰸡�C
��������
�ɲ����������֪����CO2��������2CO2+2H2O+S2-�T2HCO3-+H2S�����з���H2S+Cu2+�TCuS��+2H+�����ж�����̼��ʯ��ˮ��Ӧ���ɰ�ɫ������CaCO3��
A. ������������֪�����а�ɫ������CaCO3����A��ȷ��
B. ������ҺpH���͵�ԭ���ǣ�H2S+Cu2+�TCuS��+2H+��������ɫ��������Һ��pH���ͣ���B��ȷ��
C. ʵ������CO2���������ķ�Ӧ��2CO2+2H2O+S2�T2HCO3+H2S����C����
D. ��ǿ����ȡ�����ԭ����ʵ���͢��ܱȽ�H2CO3��H2S���Ե�ǿ������D��ȷ��
��ѡC��

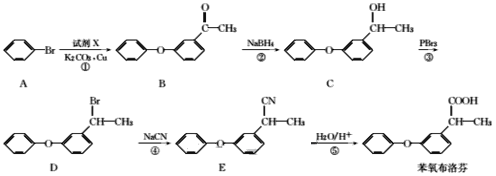
 �����ҵ���������ͯ������ϵ�д�
�����ҵ���������ͯ������ϵ�д�