题目内容
18.如图所示各物质是由1~20号元素中部分元素组成的单质或其化合物,图中部分反应条件未列出.已知C、H是无色有刺激性气味的气体,D是一种黄绿色的气体单质,物质J可用于泳池消毒.反应②和④是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法.
请回答下列问题:
(1)物质E的电子式
 ;I中所含化学键类型离子键、共价键,气体D所含元素在周期表中的位置第三周期ⅤⅡA族
;I中所含化学键类型离子键、共价键,气体D所含元素在周期表中的位置第三周期ⅤⅡA族(2)G的水溶液呈酸性,用离子方程式表示其原因NH4++H2O?NH3•H2O+H+
(3)写出E与过量I溶液反应的离子方程式CO2+Ca(OH)2=CaCO3↓+H2O.
(4)实验室制备气体C的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
(5)已知含7.4gI的稀溶液与200mL1mol/L的H溶液反应放出11.56kJ的热量,写出该反应的热化学方程式Ca(OH)2(aq)+2NH4Cl(aq)=CaCl2(aq)+2NH3↑(g)+2H2O(l)△H=-115.6kJ/mol
(6)物质A由三种元素组成,1mol A与水反应可生成1mol B和2mol C,A化学式为CaCN2.
分析 图中各物质是由1~20号元素中部分元素组成的单质或其化合物,D是一种黄绿色的气体单质,则D为Cl2,物质J可用于饮水消毒,反应④是化工生产中的重要反应,应是工业制备漂白粉原理,则I为Ca(OH)2、J为Ca(ClO)2、K为CaCl2,C是无色有刺激性气味的气体,反应⑤是实验室制备气体C,结合反应物与生成可知,为制备氨气的反应,故C为NH3、G为NH4Cl,结合转化关系可知H为HCl.F与水反应生成Ca(OH)2,则F为CaO,反应②是化工生产中的重要反应,为碳酸钙高温分解反应,故B为CaCO3、E为CO2.物质A由三种元素组成,1molA与水反应可生成1molB(CaCO3)和2molC(NH3),根据元素守恒可知A含有Ca、C、N三种元素,由原子守恒可知,A的化学式为CaCN2,据此解答.
解答 解:图中各物质是由1~20号元素中部分元素组成的单质或其化合物,D是一种黄绿色的气体单质,则D为Cl2,物质J可用于饮水消毒,反应④是化工生产中的重要反应,应是工业制备漂白粉原理,则I为Ca(OH)2、J为Ca(ClO)2、K为CaCl2,C是无色有刺激性气味的气体,反应⑤是实验室制备气体C,结合反应物与生成可知,为制备氨气的反应,故C为NH3、G为NH4Cl,结合转化关系可知H为HCl.F与水反应生成Ca(OH)2,则F为CaO,反应②是化工生产中的重要反应,为碳酸钙高温分解反应,故B为CaCO3、E为CO2.物质A由三种元素组成,1molA与水反应可生成1molB(CaCO3)和2molC(NH3),根据元素守恒可知A含有Ca、C、N三种元素,由原子守恒可知,A的化学式为CaCN2,
(1)E为CO2,其电子式为 ,I为Ca(OH)2,I中所含化学键类型为离子键、共价键,D为Cl2,气体D所含元素在周期表中的位置是第三周期ⅤⅡA族,
,I为Ca(OH)2,I中所含化学键类型为离子键、共价键,D为Cl2,气体D所含元素在周期表中的位置是第三周期ⅤⅡA族,
故答案为: ;离子键、共价键;第三周期ⅤⅡA族;
;离子键、共价键;第三周期ⅤⅡA族;
(2)G为NH4Cl,G的水溶液呈酸性,反应的离子方程式为NH4++H2O?NH3•H2O+H+,
故答案为:酸;NH4++H2O?NH3•H2O+H+;
(3)E为CO2,I为Ca(OH)2,反应的方程式为CO2+Ca(OH)2=CaCO3↓+H2O,
故答案为:CO2+Ca(OH)2=CaCO3↓+H2O;
(4)C为NH3,实验室制备气体C的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(5)含7.4g即0.1molCa(OH)2的稀溶液与200mL1mol/L的HCl溶液即含0.2molHCl,反应放出11.56kJ的热量,则1molCa(OH)2与2molHCl反应生成NH4Cl放出115.6kJ的热量,所以反应的热化学方程式为Ca(OH)2(aq)+2NH4Cl(aq)=CaCl2(aq)+2NH3↑(g)+2H2O(l)△H=-115.6kJ/mol,
故答案为:Ca(OH)2(aq)+2NH4Cl(aq)=CaCl2(aq)+2NH3↑(g)+2H2O(l)△H=-115.6kJ/mol;
(6)物质A由三种元素组成,1molA与水反应可生成1molCaCO3和2molNH3,根据元素守恒可知A含有Ca、C、N三种元素,由原子守恒可知,A的化学式为CaCN2,故答案为:CaCN2.
点评 本题考查无机物的推断,“D是黄绿色气体单质”是突破口,结合J的用途与中学常见的重要化工反应进行推断,侧重学生对元素化合物知识的熟练掌握考查,难度中等.

可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴
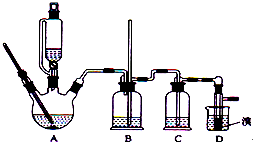 和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据列表如下:
和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据列表如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在发生反应前,分液漏斗使用前必须要检漏;在反应中,要加入沸石的作用是防暴沸,若加热后发现未加沸石,应采取的正确方法是:冷却后补加
(2)在装置B中安全管的作用原理是:当B压力过大时,安全管中液面上升,使B瓶中压力稳定
(3)判断该制各反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应从下 口出(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用d洗涤除去;(填正确选项前的字母)
a.水 b.乙醇 c.碘化钠溶液 d.氢氧化钠溶液
发生的反应方程式为:2NaOH+Br2═NaBr+NaBrO+H2O
(6)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发.
| A. | 盐酸 | B. | 烧碱溶液 | C. | AgNO3溶液 | D. | KSCN溶液 |
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
| A. | 保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol•L-1,则反应的△H<0 | |
| B. | 若在2 L恒容绝热(与外界没有热量交换)密闭容器进行该反应,化学平衡常数不变 | |
| C. | 保持其他条件不变,起始向容器中充入1.2 molCOCl2、0.60 molCl2和0.60 molCO,反应达到平衡前的速率:v(正)>v(逆) | |
| D. | 保持其他条件不变,起始向容器中充入1.0 molCl2和0.8 molCO,达到平衡时,Cl2的转化率小于60% |

| A. | 在NaCl晶体中,距Na+最近的Cl-形成正八面体 | |
| B. | 在CaF2晶体中,Ca2+、F-的配位数分别是4、8 | |
| C. | 在金刚石晶体中,碳原子与碳碳键个数的比为1:2 | |
| D. | 该气态团簇分子的分子式为EF或FE |
| 选项 | 目的 | 分离方法 | 原理 |
| A | 除去Fe(OH)3胶体中的FeCl3 | 过滤 | 分散质微粒的大小不同 |
| B | 除去纯碱中的碳酸氢铵 | 加热 | 稳定性不同 |
| C | 分离KNO3和NaCl | 重结晶 | KNO3的溶解度大于NaCl |
| D | 分离食用油和汽油 | 分液 | 食用油和汽油的密度不同 |
| A. | A | B. | B | C. | C | D. | D |
 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:(1)从如图实验装置看,其中尚缺少的一种玻璃用品是环形玻璃搅拌棒,除此之外,装置中的一个明显错误是大烧杯杯口与小烧杯杯口没有相平.
(2)为保证该实验成功该同学采取了许多措施,如图的碎纸条的作用在于隔热,减少热量的损失.
(3)若改用60mL 0.25mol•L-1H2SO4和50mL 0.55mol•L-1NaOH溶液进行反应与上述实验相比,所放出的热量不相等(填“相等”、“不相等”),若实验操作均正确,则所求中和热相等填“相等”“不相等”)
(4)倒入NaOH溶液的正确操作是:C. (从下列选出).
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(5)使硫酸与NaOH溶液混合均匀的正确操作是:D. (从下列选出).
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃棒轻轻地搅动
(6)实验数据如下表:
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4 |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)abc.
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中.