题目内容
15.用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )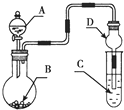
| A. | 若A为浓盐酸,B为KMnO4晶体,C是紫色石蕊溶液,则C中溶液最终呈红色 | |
| B. | 若A为浓硫酸,B为Na2SO3固体,C中是NaOH溶液,实验仪器D可以起到防止溶液倒吸的作用 | |
| C. | 若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,则C中溶液先产生白色沉淀后沉淀又溶解 | |
| D. | 若A为浓H2SO4,B为Cu,C中盛有澄清石灰水,则C中溶液变浑浊 |
分析 A.烧瓶中反应生成氯气,氯气与水反应生成盐酸和HClO,则C中紫色石蕊溶液先变红,后褪色;
B.烧瓶中反应生成二氧化硫,二氧化硫与NaOH反应,C吸收尾气,D中球形结构可防止倒吸;
C.氢氧化铝能溶于强酸和强碱,但不溶于弱碱;
D.浓硫酸和Cu的反应需要加热.
解答 解:A.若A为浓盐酸,B为KMnO4晶体,二者反应生成氯气,把氯气通到紫色石蕊溶液中,氯气与水反应生成HCl和HClO,HCl使紫色石蕊溶液变红,HClO具有漂白性,使溶液褪色,C中溶液最终呈无色,故A错误;
B.烧瓶中反应生成二氧化硫,二氧化硫与NaOH反应,C吸收尾气,D中球形干燥管中间部分较粗,盛放的液体的量较多,倒吸的液体靠自身重量回落,因此可以防止液体倒吸,故B正确;
C.若A为浓氨水,B为生石灰,滴入后反应生成氨气,氨气和铝离子反应生成氢氧化铝,但氢氧化铝不溶于氨水,所以C中产生白色沉淀不溶解,故C错误;
D.若A为浓硫酸,B为Cu,反应需要加热才能反应,如果不加热,则没有二氧化硫产生,所以C中溶液无变化,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、实验装置的作用及实验技能等为解答的关键,侧重分析与应用能力的考查,综合性较强,注意物质的性质及实验评价性分析,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.短周期主族元素W、X、Y和Z的原子序数依次增大.其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同.X是形成化合物种类最多的元素,Y的最简单氢化物与Cl2混合后产生白烟,Z元素无正化合价.根据以上叙述,下列说法中正确的是( )
| A. | 由W与X组成的化合物的沸点总高于由W与Y组成的化合物的沸点 | |
| B. | 以上四种元素的原子半径大小为W<X<Y<Z | |
| C. | W、X、Y、Z原子的核外最外层电子数的总和为23 | |
| D. | W 与 Y 可形成离子化合物 |
3.如图各装置在正常工作时,都伴随有能量变化,其中由化学能转变为电能的是( )
| A. |  电解水 | B. |  太阳能热水器 | ||
| C. |  水力发电 | D. |  干电池 |
10.能正确表示下列反应的离子方程式是( )
| A. | 硫酸铝溶液中加入过量氨水 Al3++3OH-=Al(OH)3↓ | |
| B. | 碳酸钠溶液中加入澄清石灰水 Ca(OH)2+CO32-=CaCO3↓+2OH- | |
| C. | 冷的氢氧化钠溶液中通入氯气 Cl2+2OH-=ClO-+Cl-+H2O | |
| D. | 稀硫酸中加入铁粉 2Fe+6H+=2Fe3++3H2↑ |
20.下列有关说法正确的是( )
| A. | 元素周期表中位于金属与非金属分界线附近的元素属于过渡元素 | |
| B. | 水是一种非常稳定的化合物,这是由于氢键所致 | |
| C. | 由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S | |
| D. | 离子化合物中可能含有共价键 |
7.氢氧燃料电池已用于航天飞机.以30% KOH溶液为电解质溶液的这种电池在使用时的电极反应如下:2H2+4OH--4e-═4H2O、O2+2H2O+4e-═4OH-.据此作出判断,下列说法中正确的是( )
| A. | H2在正极发生氧化反应 | |
| B. | 供电时的总反应为:2H2+O2═2H2O | |
| C. | 燃料电池将H2燃烧放出的热能转化为电能 | |
| D. | 从电极反应式可知,反应后KOH溶液的浓度不变 |
4.在一定条件下,RO3n-和I-发生反应的离子方程式为RO3n-+6I-+6H+═R-+3I2+3H2O,则RO3n-中R元素的化合价与R元素的最外层电子数分别为( )
| A. | +5,7 | B. | +5,5 | C. | +7,7 | D. | +6,6 |