题目内容
5.在密闭容器中,发生如下反应:N2O4(g)?2NO2(g),△H>0,当反应达平衡后,改变下列条件,则指定物质的浓度及平衡如何变化:(1)保持容器体积不变,降低温度,平衡向逆向移动(填“正向”,“逆向”或“不”),混合气体的颜色变浅(填“变深”,“变浅”或“不变化”)
(2)保持温度不变,减小容器体积,反应速率加快(填“加快”,“减慢”或“不变化”),平衡向逆向移动(填“正向”,“逆向”或“不”),混合气体的颜色变深(填“变深”,“变浅”或“不变化”)
(3)保持容器体积和温度不变,通入N2,平衡向不移动(填“正向”,“逆向”或“不”),混合气体的颜色不变化(填“变深”,“变浅”或“不变化”)
(4)保持容器压强和温度不变,通入Ar,平衡向正向移动(填“正向”,“逆向”或“不”),混合气体的颜色变浅(填“变深”,“变浅”或“不变化”)
分析 根据N2O4(g)?2NO2(g),△H>0,该反应为气体体积增大的吸热反应,根据平衡移动原理分析解答.
解答 解:(1)因为N2O4(g)?2NO2(g),△H>0,该反应为气体体积增大的吸热反应,所以保持容器体积不变,降低温度,平衡向放热方向即逆向移动,二氧化氮浓度减小,则混合气体的颜色变浅,故答案为:逆向;变浅;
(2)因为N2O4(g)?2NO2(g),△H>0,该反应为气体体积增大的吸热反应,所以保持温度不变,减小容器体积即增大压强,则反应速率加快,平衡向体体积减小即逆向移动,虽然二氧化氮物质的量减小,但减小容器体积,所以二氧化氮浓度仍然增大,所以混合气体的颜色变深,故答案为:加快;逆向;变深;
(3)保持容器体积和温度不变,通入N2,反应物生成物浓度不变平衡不移动,混合气体的颜色不变化,故答案为:不;不变化;
(4)保持容器压强和温度不变,通入Ar,体积增大,相当于减小反应体系的压强,则平衡向气体体积增大及正向移动,又体积增大,所以二氧化氮浓度减小,则混合气体的颜色变浅,故答案为:正向;变浅.
点评 本题主要考查了温度、压强对平衡移动的影响,难度不大,注意基础知识的积累.

练习册系列答案
相关题目
15.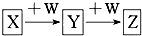 X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如图所示转化关系(其他产物已略):下列说法不正确的是( )
X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如图所示转化关系(其他产物已略):下列说法不正确的是( )
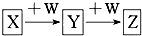 X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如图所示转化关系(其他产物已略):下列说法不正确的是( )
X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如图所示转化关系(其他产物已略):下列说法不正确的是( )| A. | 若W是单质铁,则Z溶液可能是FeCl2溶液 | |
| B. | 若X是金属铝,则W可能是强碱 | |
| C. | 若W是氢氧化钠,则X与Z可能反应生成Y | |
| D. | 若X为氧气,则X与Y的相对分子质量可能相差12 |
13.将几种铁的氧化物的混合物加入100mL、7mol•L-1的盐酸中.氧化物恰好完全溶解,在所得的溶液中通入0.56L(标准状况)氯气时,恰好使溶液中的Fe2+完全转化为Fe3+,则该混合物中铁元素的质量分数为( )
| A. | 72.4% | B. | 71.4% | C. | 79.0% | D. | 63.6% |
20.下列物质中能抑制水的电离且使溶液呈现出酸性的是( )
| A. | Na2CO3 | B. | NaOH | C. | K2SO4 | D. | H2SO4 |
10.下表是元素周期表的一部分.表中所列的字母分别代表某一化学元素.
请用具体的元素符号填写下面空格:
(1)以上元素中,第一电离能最大的是Ar;电负性最大的金属是O.
(2)i、j、l 三种元素最高价氧化物对应的水化物中,酸性最强的是HClO4
(3)根据元素原子的外围电子排布的特征,可将元素周期表分成几个区域,其中,元素c、m分别位于ds区、p区.
(4)下表是一些气态基态原子的第一、二、三、四级电离能(kJ•mol-1):
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量Li原子失去1个电子后形成稳定结构,再失去1个电子很困难
②表中X可能为以上元素中的Al元素.用元素符号表示a和h形成化合物的电子式是 和
和 .
.
| b | |||||||||||||||||
| h | |||||||||||||||||
| a | f | i | j | l | m | ||||||||||||
| e | c | g | |||||||||||||||
(1)以上元素中,第一电离能最大的是Ar;电负性最大的金属是O.
(2)i、j、l 三种元素最高价氧化物对应的水化物中,酸性最强的是HClO4
(3)根据元素原子的外围电子排布的特征,可将元素周期表分成几个区域,其中,元素c、m分别位于ds区、p区.
(4)下表是一些气态基态原子的第一、二、三、四级电离能(kJ•mol-1):
| 锂 | X | |
| 第一电离能 | 519 | 580 |
| 第二电离能 | 7296 | 1820 |
| 第三电离能 | 11799 | 2750 |
| 第四电离能 | 11600 |
②表中X可能为以上元素中的Al元素.用元素符号表示a和h形成化合物的电子式是
 和
和 .
.
14.下列粒子半径最大的是( )
| A. | Na+ | B. | P | C. | Cl | D. | F |
15.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 10g甲烷中所含有的电子数目为10NA | |
| B. | 常温常压下,4g氦气所含有的质子数目为4NA | |
| C. | 标准状况下,22.4L单质溴所含有的原子数目为2NA | |
| D. | Fe-Cu和稀硫酸构成的原电池中,若生成2gH2,则转移的电子数目为2NA |


