题目内容
15.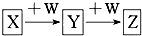 X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如图所示转化关系(其他产物已略):下列说法不正确的是( )
X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如图所示转化关系(其他产物已略):下列说法不正确的是( )| A. | 若W是单质铁,则Z溶液可能是FeCl2溶液 | |
| B. | 若X是金属铝,则W可能是强碱 | |
| C. | 若W是氢氧化钠,则X与Z可能反应生成Y | |
| D. | 若X为氧气,则X与Y的相对分子质量可能相差12 |
分析 由反应的转化关系可知X可与W连续反应,说明X的生成物与W的量或反应条件有关,符合该转化关系的有:氢氧化钠或氢氧化钾与二氧化碳和二氧化硫的反应、铁和硝酸或氯化铁溶液的反应、偏铝酸盐和盐酸的反应、氯化铝和氢氧化钠溶液的反应、氨气或氮气或硫被氧化的反应、钠被氧化的反应等,以此解答该题.
解答 解:A.如果W是Fe,Z是FeCl2,则Y必是FeCl3,发生的化学反应是2FeCl2+Cl2═2FeCl3,则X是Cl2,符合题干要求,故A正确;
B.若X是金属铝,W是NaOH溶液,则Y为NaAlO2,NaAlO2与NaOH不反应,故B错误;
C.若W是氢氧化钠,说明X能连续与氢氧化钠反应,即Y应是氢氧化物,Y能与氢氧化钠继续反应,说明氢氧化物Y具有酸性,则Y必是氢氧化铝,则X必是含有Al3+的溶液,Al3+水解使溶液呈酸性.Z是AlO2-,Al3+的溶液和AlO2-溶液混合生成氢氧化铝沉淀,故C正确;
D.若X是氧气,W是C,Y是CO2,Z是CO,则X和Y相对分子质量相差12,故D正确.
故选B.
点评 本题考查了无机物的推断,侧重于学生的分析能力的考查,注意把握物质转化关系的应用,物质性质的综合应用,主要考查物质连续反应的特征应用,熟练掌握元素化合物的性质是解题关键,难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
15.电池是人类生产和生活中的重要的能量来源,各式各样电池的发明是化学对人类的一项重大贡献.下列有关电池的叙述正确的是( )
| A. | 构成电池的两极必须是活泼性不同的金属 | |
| B. | 锌锰干电池工作时,电池内部的电流方向由碳棒流向锌桶 | |
| C. | 甲醇燃料电池工作时,甲醇在负极发生氧化反应 | |
| D. | 银锌纽扣电池工作时,电子由锌极流出经过溶液后流向银极 |
6.一定量的乙醛发生银镜反应,析出银21.6g.等量的此醛完全燃烧时,生成的水为( )
| A. | 5.4g | B. | 3.6g | C. | 1.8g | D. | 2.4g |
3.美国墨西哥湾英国石油公司的一海上石油钻探平台发生爆炸,大量石油泄漏,给墨西哥湾海域带来巨大的经济损失和生态灾难.下列关于石油加工的叙述中,错误的是( )
| A. | 石油分馏所得的馏分是一种具有固定熔、沸点的纯净物 | |
| B. | 石油裂化的主要目的是提高汽油等轻质油的产量 | |
| C. | 石油裂解的原料是石油分馏产物,包括石油气 | |
| D. | 石油在催化剂的作用下加热,可以使链状烃转化为环状烃(如苯、甲苯等) |
10.氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池.氢镍电池的总反应式是 $\frac{1}{2}$H2+NiO(OH)$?_{充电}^{放电}$Ni(OH)2,根据此反应式判断,下列叙述中不正确的是( )
| A. | 电池放电时,H2参与负极反应,发生氧化反应 | |
| B. | 电池放电时,镍元素被氧化 | |
| C. | 电池放电时,电子从氢气这一极到NiO(OH) 这一极 | |
| D. | 电池充电时,电能转化为化学能 |
20.某化学反应物的总能量小于生成物的总能量,则该反应( )
| A. | 是吸热反应 | B. | 是放热反应 | ||
| C. | 不一定遵循质量守恒定律 | D. | 必须需要加热才能发生 |
7.下列物质按纯净物、混合物、电解质、非电解质的顺序组合的一组为( )
| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 蒸馏水 | 氨水 | 氧化铝 | 二氧化硫 |
| B | 盐酸 | 空气 | 硫酸 | 干冰 |
| C | 胆矾 | 盐酸 | 铁 | 碳酸钙 |
| D | 生石灰 | 硫酸 | 氯化铜 | 碳酸钠 |
| A. | A | B. | B | C. | C | D. | D |
4.下列关于胶体和溶液的说法中,正确的是( )
| A. | 许多胶体能进行电泳是因为这些胶体带电 | |
| B. | 布朗运动是胶体粒子特有的运动方式,可以据此把胶体与溶液、悬浊液区分 | |
| C. | 光线通过时,胶体产生丁达尔效应,溶液则无丁达尔效应 | |
| D. | 将饱和氯化铁溶液滴入稀氢氧化钠溶液中加热,可得氢氧化铁胶体 |