题目内容
 氨气是生产氮肥、硝酸、纯碱等的重要原料.
氨气是生产氮肥、硝酸、纯碱等的重要原料.(1)实验室模拟合成氨.在恒温恒容密闭容器中按照甲、乙、丙三种方式分别投料(单位是mol/L),平衡时测得甲容器中H2的转化率为20%.
| N2 | H2 | NH3 | |
| 甲 | 1 | 3 | 0 |
| 乙 | 0.5 | 1.5 | 1 |
| 丙 | 0 | 0 | 4 |
②乙容器中开始反应时,v逆
③达平衡时,甲、乙、丙三容器中NH3的体积分数由大到小的顺序为
(2)工业上以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如下:
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)
| n(NH3) |
| n(CO2) |
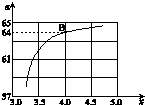
③如图中的B点处,NH3的平衡转化率为
考点:化学平衡建立的过程,化学平衡常数的含义,化学平衡的影响因素,化学平衡的计算
专题:化学平衡专题
分析:(1)①根据氢气的转化率,利用三段式分析计算;
②将乙容器中起始的各物质折算成反应物与甲容器比较,结合①中的数据作判断;
③根据影响平衡移动的外界条件判断;
(2)①根据温度对平衡移动的影响判断;
②根据浓度对平衡的影响判断;
③根据化学方程式利用三段式进行计算.
②将乙容器中起始的各物质折算成反应物与甲容器比较,结合①中的数据作判断;
③根据影响平衡移动的外界条件判断;
(2)①根据温度对平衡移动的影响判断;
②根据浓度对平衡的影响判断;
③根据化学方程式利用三段式进行计算.
解答:
解:(1)①利用三段式,
3H2(g)+N2(g)?2NH3(g)
起始(mol/L) 3 1 0
转化(mol/L) 0.6 0.2 0.4
平衡(mol/L) 2.4 0.8 0.4
所以,平衡时甲容器中氨气的浓度为0.4mol/L,故答案为:0.4mol/L;
②将乙容器中起始的各物质折算成反应物得,氢气3mol/L,氮气1mol/L,与甲容器起始量相同,所以与甲容器中反应为等效平衡,结合甲容器中平衡时的数据可知,容器乙中反应要逆向进行,所以v逆>v正,故答案为:>;
③将丙容器中氨气折算成反应物,与甲容器比较,起始物质的量都是甲容器中的2倍,由于容器体积相同,所以压强大,而该反应为体积减小的反应,加压平衡正向移动,氨的体积分数增大,而甲、乙是互为等效平衡,氨的体积分数相同,故答案为:丙>甲=乙;
(2)①根据表中数据可知,温度升高平衡常数减小,平衡逆向移动,所以该反应的正反应为放热反应,故答案为:<;
②增加氨气的浓度,平衡向正反应方向移动,二氧化碳的起始量没有变化,所以二氧化碳的转化率增大,即X值越大,CO2平衡转化率越高,故答案为:c(NH3)增大,平衡正向移动;
③根据三段式进行计算,设二氧化碳起始物质的量为1mol,
2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(l),
起始(mol) 4 1 0 0
转化(mol) 1.28 0.64
平衡(mol) 2.72 0.36
所以NH3的平衡转化率为
×100%=32%,故答案为:32%.
3H2(g)+N2(g)?2NH3(g)
起始(mol/L) 3 1 0
转化(mol/L) 0.6 0.2 0.4
平衡(mol/L) 2.4 0.8 0.4
所以,平衡时甲容器中氨气的浓度为0.4mol/L,故答案为:0.4mol/L;
②将乙容器中起始的各物质折算成反应物得,氢气3mol/L,氮气1mol/L,与甲容器起始量相同,所以与甲容器中反应为等效平衡,结合甲容器中平衡时的数据可知,容器乙中反应要逆向进行,所以v逆>v正,故答案为:>;
③将丙容器中氨气折算成反应物,与甲容器比较,起始物质的量都是甲容器中的2倍,由于容器体积相同,所以压强大,而该反应为体积减小的反应,加压平衡正向移动,氨的体积分数增大,而甲、乙是互为等效平衡,氨的体积分数相同,故答案为:丙>甲=乙;
(2)①根据表中数据可知,温度升高平衡常数减小,平衡逆向移动,所以该反应的正反应为放热反应,故答案为:<;
②增加氨气的浓度,平衡向正反应方向移动,二氧化碳的起始量没有变化,所以二氧化碳的转化率增大,即X值越大,CO2平衡转化率越高,故答案为:c(NH3)增大,平衡正向移动;
③根据三段式进行计算,设二氧化碳起始物质的量为1mol,
2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(l),
起始(mol) 4 1 0 0
转化(mol) 1.28 0.64
平衡(mol) 2.72 0.36
所以NH3的平衡转化率为
| 1.28 |
| 4 |
点评:本题主要考查了根据化学平衡的计算、等效平衡、转化率的计算等知识点,中等难度,有一定的综合性.

练习册系列答案
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案
相关题目
下列物质在同条件下,导电能力最强的是( )
| A、98%的浓硫酸 |
| B、浓盐酸 |
| C、澄清石灰水 |
| D、硫酸钠晶体 |
接触法制硫酸的工业生产中,下列生产操作及原因解释均正确的是( )
| A、硫铁矿燃烧前需要粉碎,因为块状硫铁矿不能燃烧 |
| B、SO2氧化为SO3需要高压,可以提高SO2的转化率 |
| C、SO2氧化为SO3需要使用催化剂,可以提高SO2的转化率 |
| D、用98.3%的浓硫酸吸收SO3,可以提高SO3的吸收效率 |
下列变化能够实现的是( )
①弱酸与盐溶液反应生成强酸
②两种氧化物发生反应有气体生成
③两种酸的溶液充分反应后溶液呈中性
④复分解反应中既没有生成水,也没有生成沉淀和气体
⑤两种无色气体常温常压下混合后气体颜色加深
⑥有单质生成的非氧化还原反应.
①弱酸与盐溶液反应生成强酸
②两种氧化物发生反应有气体生成
③两种酸的溶液充分反应后溶液呈中性
④复分解反应中既没有生成水,也没有生成沉淀和气体
⑤两种无色气体常温常压下混合后气体颜色加深
⑥有单质生成的非氧化还原反应.
| A、全部 | B、只有①③⑤ |
| C、只有②④⑥ | D、只有①②③④ |
下列说法不正确的是( )
| A、钢铁发生电化学腐蚀时,负极发生的反应是2H2O+O2+4e-=4 OH- |
| B、在空气中,金属铝表面能迅速被氧化形成保护膜,因此铝不容易被腐蚀 |
| C、铸铁输油管道应埋在干燥致密不透气的土壤中 |
| D、白铁(镀Zn铁)表面有划损时,也能阻止铁被氧化 |
已知某饱和溶液的:①溶液的质量 ②溶剂的质量 ③溶液的体积 ④溶质的摩尔质量 ⑤溶质的溶解度 ⑥溶液的密度,从上述条件的组合中,不能用来计算溶液物质的量浓度的是( )
| A、④⑤⑥ | B、①②③④ |
| C、①③④ | D、①③④⑤ |
