题目内容
19.25℃时有甲、乙、丙三种溶液,甲为0.1mol•L-1 NaOH溶液,乙为0.1mol•L-1HCl溶液,丙为0.1mol•L-1CH3COOH溶液,请回答下列问题:(1)甲溶液的pH=13,丙溶液的pH>1(填“<”、“>”或“=”).
(2)乙溶液中由水电离出的c(H+)=10-13mol•L-1.
(3)写出丙的电离方程式CH3COOH?H++CH3COO-,其电离平衡常数表达式Ka=$\frac{c({H}^{+}).c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$.
(4)向丙中加入乙,会抑制(“抑制”或“促进”)丙的电离,c(H+)增大(填“增大”、“减小”或“不变”),丙的电离平衡常数Ka不变(填“增大”、“减小”或“不变”).
(5)各取25mL的乙、丙两溶液,分别用甲中和至pH=7,则消耗甲的体积大小关系为V(乙)大于V (丙) (填“大于”、“小于”或“等于”).
分析 (1)先计算溶液中c(H+),再根据pH=-lgc(H+)计算溶液的pH;醋酸是弱电解质,在水溶液中部分电离;
(2)酸溶液中水电离出的c(H+)=$\frac{{K}_{w}}{c({H}^{+})}$;
(3)醋酸是弱电解质,在水溶液中部分电离;其电离平衡常数等于c(CH3COO-)、c(H+)之积与c(CH3COOH)的比;
(4)向丙中加入乙,会产生同离子效应而抑制丙电离;电离平衡常数只与温度有关;
(5)NaCl是强酸强碱盐,其水溶液呈中性,醋酸钠是强碱弱酸盐,其水溶液呈碱性,要使醋酸钠溶液呈中性,醋酸应该稍微多些.
解答 解:(1)甲溶液中c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$=$\frac{1{0}^{-14}}{0.1}$mol/L=10-13 mol/L,pH=-lgc(H+)=-lg10-13=13;
丙中醋酸是弱电解质,在水溶液中部分电离,所以氢离子浓度小于酸浓度,则该溶液中c(H+)<0.1mol/L,所以溶液的pH>1,
故答案为:13;>;
(2)酸溶液中水电离出的c(H+)=$\frac{{K}_{w}}{c({H}^{+})}$=$\frac{1{0}^{-14}}{0.1}$mol/L=10-13 mol/L,故答案为:10-13;
(3)醋酸是弱电解质,在水溶液中部分电离,其电离方程式为CH3COOH?H++CH3COO-;其电离平衡常数等于c(CH3COO-)、c(H+)之积与c(CH3COOH)的比,所以Ka=$\frac{c({H}^{+}).c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$,
故答案为:CH3COOH?H++CH3COO-;Ka=$\frac{c({H}^{+}).c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$;
(4)向丙中加入乙,乙电离出氢离子而导致溶液中c(H+)增大,会产生同离子效应而抑制丙电离,则抑制丙电离;电离平衡常数只与温度有关,温度不变,电离平衡常数不变,
故答案为:抑制;增大;不变;
(5)NaCl是强酸强碱盐,其水溶液呈中性,醋酸钠是强碱弱酸盐,其水溶液呈碱性,要使醋酸钠溶液呈中性,醋酸应该稍微多些,所以各取25mL的乙、丙两溶液,分别用甲中和至pH=7,则消耗甲的体积大小关系为V(乙)>V (丙),且乙和甲的体积相等,故答案为:大于.
点评 本题考查弱电解质的电离及酸碱混合溶液定性判断等知识点,为高频考点,明确弱电解质电离特点及弱电解质电离影响因素是解本题关键,注意(4)中电离平衡常数只与温度有关,与溶液酸碱性及浓度无关,题目难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | K+、CO32-、NO3-、Cl- | B. | Na+,NH4+、Cl-,SO42- | ||
| C. | NH4+、K+、HCO3-、Cl- | D. | Na+、Ba2+、Br-、Cl- |
| A. | 容量瓶中原有少量蒸馏水 | |
| B. | 定容时观察液面俯视 | |
| C. | 滴管加水时,有少量水滴到容量瓶外 | |
| D. | 溶液从烧杯转移到容量瓶中后没有洗涤烧杯 |
| A. | 在配制前用稀硫酸润洗容量瓶后,未用蒸馏水洗涤 | |
| B. | 定容摇匀后,发现液面低于刻度线,再加入蒸馏水至与刻度线相切 | |
| C. | 洗涤量筒,并将洗涤液转入容量瓶 | |
| D. | 定容时仰视读数. |
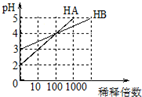
| A. | 向等体积等浓度的HA和HB溶液中滴加等浓度的NaOH溶液,至至溶液呈中性,HB消耗的NaOH多 | |
| B. | 加水稀释HB酸溶液,则c(H+)/c(HB)减小 | |
| C. | 常温下,用pH=a的V1L HA酸与pH=b的V2L NaOH溶液混合,若a+b=14,则反应后溶液呈中性 | |
| D. | 若向等体积等pH的HB和HA酸溶液加入足量锌粉,均反应生成H2,最终HB生成的H2多 |
| A. | 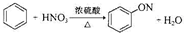 | |
| B. | H2C=CH2+Br2→CH3CHBr2 | |
| C. | CH3COOH+CH3CH2OH $→_{△}^{浓硫酸}$ CH3CH2OCH2CH3+H2O | |
| D. | CH4+2O2 $\stackrel{点燃}{→}$ CO2+2H2O |
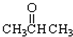 ③CH3CH2Br ④
③CH3CH2Br ④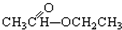 ⑤
⑤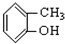 ⑥
⑥ ⑦
⑦ ⑧
⑧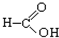 ⑨
⑨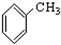 ⑩
⑩