题目内容
1.如图为某化学反应的能量-反应进程图,由此可判断该反应( )
| A. | 为放热反应 | B. | 为吸热反应 | C. | 属于燃烧反应 | D. | 属于中和反应 |
分析 根据图表,反应物的总能量小于生成物的总能量,则为吸热反应,据此分析.
解答 解:根据图表,反应物的总能量小于生成物的总能量,则为吸热反应,燃烧反应,中和反应都是放热反应,所以只有B正确,故选:B.
点评 本题考查了反应能量变化的分析判断,图象分析是解题关键,反应的能量守恒是判断的依据,比较简单.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
3.一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示:下列判断正确的是( )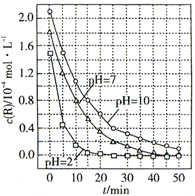

| A. | 溶液酸性越强,R的降解速率越小 | |
| B. | R的起始浓度越小,降解速率越大 | |
| C. | 在0~50 min之间,pH=2和pH=7时R的降解百分率相等 | |
| D. | 在20~25 min之间,pH=10时R的平均降解速率为0.02 mol•L-1•min-1 |
6.两种气态烃的混和物共0.1mol,完全燃烧后得到3.36L(标准状况下)CO2和3.6g水,下列说法正确的是( )
| A. | 可能为甲烷和乙烷的混合物 | B. | 一定有乙烯 | ||
| C. | 混合物中可能含有丙烷 | D. | 两种气态烃一定都有四个H原子 |
10.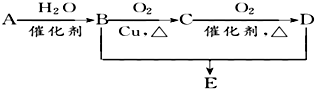 有机物A的结构简式为CH2=CH2,可发生以下系列转化,已知B、D是生活中常见的两种有机物,D的水溶液呈酸性,B与D的反应为酯化反应.下列说法不正确的是( )
有机物A的结构简式为CH2=CH2,可发生以下系列转化,已知B、D是生活中常见的两种有机物,D的水溶液呈酸性,B与D的反应为酯化反应.下列说法不正确的是( )
 有机物A的结构简式为CH2=CH2,可发生以下系列转化,已知B、D是生活中常见的两种有机物,D的水溶液呈酸性,B与D的反应为酯化反应.下列说法不正确的是( )
有机物A的结构简式为CH2=CH2,可发生以下系列转化,已知B、D是生活中常见的两种有机物,D的水溶液呈酸性,B与D的反应为酯化反应.下列说法不正确的是( )| A. | 由B、D制备E常用浓H2SO4作脱水剂 | |
| B. | D、E都能与NaOH溶液反应 | |
| C. | E、D、B三种物质可以用饱和Na2CO3溶液鉴别 | |
| D. | 75%的B溶液常用于医疗消毒 |
11.设NA为阿伏加德罗常数的值.下列说法一定正确的是( )
| A. | 25℃,pH=13的NaOH溶液中含有OH-为0.1NA | |
| B. | 1 L 0.1 mol•L-1 CuSO4溶液中含有Cu2+为0.1NA | |
| C. | 2.24 L N2和NH3混合气体中原子间含有的共用电子对数目为0.3NA | |
| D. | 2 mol SO2和1 mol O2在一定条件下充分反应后,所得混合气体的分子数大于2NA |
 .
. .
. .
.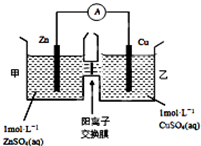 化学与人类生产和生活中密切相关,掌握有关的化学基础知识可以改善我们的生活.
化学与人类生产和生活中密切相关,掌握有关的化学基础知识可以改善我们的生活.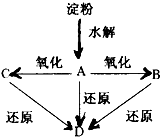 如图所示,淀粉水解可产生某有机化合物A,A在不同的氧化剂作用下可以生成B(C6H12O7)或C(C6H10O8),B和C都不能发生银镜反应.A、B、C都可以被强还原剂还原成为D(C6H14O6).已知,相关物质被氧化的难易次序是:RCHO最易,R-CH2OH次之,
如图所示,淀粉水解可产生某有机化合物A,A在不同的氧化剂作用下可以生成B(C6H12O7)或C(C6H10O8),B和C都不能发生银镜反应.A、B、C都可以被强还原剂还原成为D(C6H14O6).已知,相关物质被氧化的难易次序是:RCHO最易,R-CH2OH次之,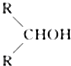 最难.
最难.