题目内容
8.常温下,某溶液中由水电离的c(H+)=1×10-13mol/L,该溶液可能是( )①NH4Cl溶液,②SO2水溶液,③NaNO3溶液,④NaOH溶液.
| A. | ①④ | B. | ①② | C. | ②③ | D. | ②④ |
分析 酸、碱或强酸酸式盐都抑制水电离,含有弱离子的盐促进水电离,常温下,某溶液中由水电离的c(H+)=1×10-13 mol•L-1<1×10-7mol•L-1,说明水的电离受到抑制,说明为酸溶液或碱溶液,据此分析解答.
解答 解:酸、碱或强酸酸式盐都抑制水电离,含有弱离子的盐促进水电离,常温下,某溶液中由水电离的c(H+)=1×10-13 mol•L-1<1×10-7mol•L-1,说明水的电离受到抑制,则溶液中的溶质为酸或碱溶液.
①NH4Cl溶液是强酸弱碱盐溶液,氯化铵的水解对水的电离有促进作用,故错误;
②SO2水溶液即亚硫酸溶液,是酸溶液,对水的电离有抑制作用,故正确;
③NaNO3溶液是强酸强碱盐溶液,不能水解,对水的电离无影响,故错误;
④NaOH溶液是强碱溶液,对水的电离有抑制作用,故正确.
故选D.
点评 本题考查了酸或碱对水的电离的影响,难度不大,应注意的是酸或碱对水的电离有抑制作用,盐类的水解对水的电离有促进作用.

练习册系列答案
相关题目
16.化学不仅在书本里,还在生活中.比如厨房里常用小苏打或苏打粉去除鱼腥味,而残留的小苏打或苏打粉异味则应用下列哪种物品去除( )
| A. | 陈醋 | B. | 食盐 | C. | 味精 | D. | 花生油 |
13.下列关于强、弱电解质的叙述正确的是?( )
| A. | 强酸、强碱及大部分盐类属于强电解质,弱酸、弱碱属于弱电解质 | |
| B. | 所有的离子化合物都是强电解质,所有的共价化合物都是弱电解质 | |
| C. | 强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 | |
| D. | SO2的水溶液能导电,所以SO2是电解质 |
18.从周期表推测,若存在116号元素,下列性质推断正确的是( )
| A. | 其钠盐的化学式为Na2X | B. | X是金属元素 | ||
| C. | 其最高价氧化物的水化物为强酸 | D. | 其最高价氧化物为XO3 |
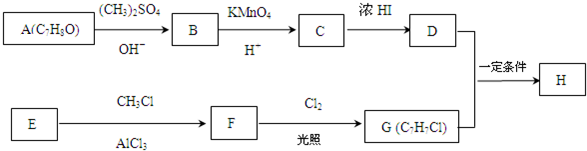
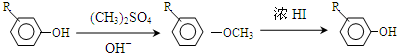
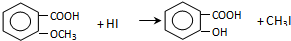 .
.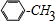 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$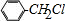 +HCl,反应类型为取代反应.
+HCl,反应类型为取代反应.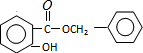 .
. (或
(或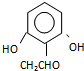 .
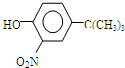
.
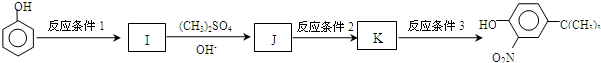
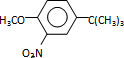 ,反应条件3所用的试剂为浓HI.
,反应条件3所用的试剂为浓HI.