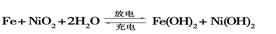题目内容
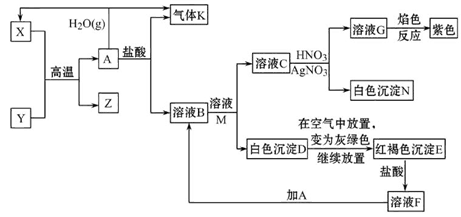
A、B、C、D是中学化学中常见的单质, D为地壳中含量最多的金属;甲、乙、丙为化合物,其中甲为有磁性的黑色晶体,乙在常温常压下为无色液体。各物质的转化关系如下: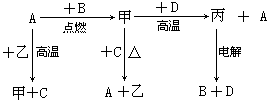
(1)组成D的元素在周期表中的位置是 。
(2)若用一种反应类型概括上述转化中所涉及到的全部反应,该反应类型是 。
(3)在上述电解反应中,阳极的电极反应式是 。
(4)甲和D反应的化学方程式是 。
(5)D的某种盐常用于净水,用离子方程式表示其净水原理 。
(1)第三(3)周期,第ⅢA(三、3主)族(各1分)。
(2)氧化还原反应
(3)2O2—-4e—=O2↑(或6O2—+12e—=3O2↑,没配平给1分,无↑不扣分。)
(4)3Fe3O4+8Al 9Fe+4Al2O3(没配平给1分,无△不扣分)
9Fe+4Al2O3(没配平给1分,无△不扣分)
(5)Al3++3H2O Al(OH)3+3H+(没配平扣1分,无可逆号或标↓扣1分,同时具有前述两项或以上0分。)
Al(OH)3+3H+(没配平扣1分,无可逆号或标↓扣1分,同时具有前述两项或以上0分。)
解析试题分析:根据题意,D为地壳中含量最多的金属是Al,甲为有磁性的黑色晶体Fe3O4, Fe和水在高温下生成Fe3O4和H2 ,A是Fe ,C是H2 ,又Fe在纯氧气中燃烧生成Fe3O4 ,甲和D是铝热反应,丙是Al2O3,电解氧化铝得到氧气和铝,依次解答;(1)D是铝在周期表中的位置是第三周期,IIIA族;(2)各个反应均有单质参加或生成,都有化合价变化,均属于氧化还原反应;(3)电解氧化铝,阳极是O2- 失电子生成O2;(4)铝和四氧化三铁发生铝热反应:3Fe3O4+8Al  9Fe+4Al2O3 ;(5)明矾净水,利用铝离子水解Al3++3H2O
9Fe+4Al2O3 ;(5)明矾净水,利用铝离子水解Al3++3H2O Al(OH)3(胶体)+3H+。
Al(OH)3(胶体)+3H+。
考点:金属及其化合物。

二元弱酸是分步电离的,25时碳酸和草酸的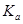 如下表:
如下表:
| H2CO3 | Ka1=4.3×10-7 | H2C2O4 | Ka1=5.6×10-2 |
| Ka2=5.6×10-11 | Ka2=5.42×10-5 |
(1)设有下列四种溶液:
A.0.1 mol/L的Na2C2O4溶液 B.0.1 mol/L的NaHC2O4溶液
C.0.1 mol/L的Na2CO3溶液 D.0.1 mol/L的NaHCO3溶液
其中,c(H+)最大的是_________,c(OH-)最大的是_________ 。
(2)某化学实验兴趣小组同学向用大理石和稀盐酸制备CO2后残留液中滴加碳酸钠溶液,在溶液中插人pH传感器,测得pH变化曲线如图所示。
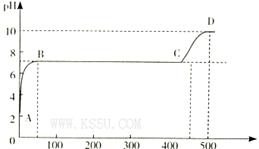
刚开始滴人碳酸钠溶液时发生反应的离子方程式为_________,BC段发生反应的离子方程式为_____,D点时混合溶液中由水电离产生的c(H+)="_________" mol/L。
在实验室里,某同学取一小块金属钠做钠与水反应的实验。试完成下列问题:
(1)切开的金属钠暴露在空气中,最先观察到的现象是____________________________,所发生反应的化学方程式是_______________________________________________。
(2)将钠投入水中后,钠熔化成一个小球,根据这一现象你能得出的结论是
①_______________________________________________,
②_______________________________________________。
将一小块钠投入盛有饱和石灰水的烧杯中,不可能观察到的现象是________。
| A.有气体生成 |
| B.钠熔化成小球并在液面上游动 |
| C.烧杯底部有银白色的金属钙生成 |
| D.溶液变浑浊 |