题目内容
可逆反应①X(g)+2Y(g)═2Z(g)、②2M(g)═N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板.反应开始和达到平衡状态时有关物理量的变化如图所示:

反应①的正反应是 反应(填“放热”或“吸热”);达平衡(I)时体系的压强与反应开始时体系的压强之比为 ;达平衡(I)时,X的转化率为 .

反应①的正反应是
考点:化学平衡的计算,化学平衡建立的过程
专题:化学平衡专题
分析:根据右室的混合物总物质的量不变,平衡(I)、平衡(Ⅱ)左右两室的温度、压强相同,体积之比等于物质的量之比,结合图示容器容积变化判断降温后反应①平衡移动的方向;
根据右室的混合物总物质的量不变,在同温同压下体积比等于物质的量之比计算出反应后(I)中混合气体的物质的量,再计算出达平衡(I)时体系的压强与反应开始时体系的压强之比;
设参加反应的X的物质的量为amol,利用差量法计算a的值,再利用转化率定义计算X的转化率.
根据右室的混合物总物质的量不变,在同温同压下体积比等于物质的量之比计算出反应后(I)中混合气体的物质的量,再计算出达平衡(I)时体系的压强与反应开始时体系的压强之比;
设参加反应的X的物质的量为amol,利用差量法计算a的值,再利用转化率定义计算X的转化率.
解答:
解:右室的混合物总物质的量不变,平衡(I)、平衡(Ⅱ)左右两室的温度、压强相同,体积之比等于物质的量之比,由图可知,平衡(I)降低温度达新平衡平衡(Ⅱ),隔板由2.8处移至2.6处,左室的气体的物质的量减小,降低温度平衡向正反应移动,降低温度平衡向放热反应移动,故该反应正反应为放热反应;
右室的混合物总物质的量不变为2mol,左右两室的压强、温度相等,同温同压下,体积之比等于物质的量之比,平衡(I)中左室混合气体总的物质的量为
×2mol=
mol,所以达平衡(I)时体系的压强与反应开始时体系的压强之比为
mol:3=28:33;
平衡(I)中左室混合气体总的物质的量为
mol,设参加反应的A的物质的量为amol,则:
X(g)+2Y(g)?2Z(g) 物质的量减少△n
1 1
amol (3mol-
mol)=
mol
解得a=
mol,所以X的转化率为
=
,
故答案为:放热;28:33;
.
右室的混合物总物质的量不变为2mol,左右两室的压强、温度相等,同温同压下,体积之比等于物质的量之比,平衡(I)中左室混合气体总的物质的量为
| 2.8 |
| 2.2 |
| 28 |
| 11 |
| 28 |
| 11 |
平衡(I)中左室混合气体总的物质的量为
| 28 |
| 11 |
X(g)+2Y(g)?2Z(g) 物质的量减少△n
1 1
amol (3mol-
| 28 |
| 11 |
| 5 |
| 11 |
解得a=
| 5 |
| 11 |
| ||
| 1mol |
| 5 |
| 11 |
故答案为:放热;28:33;
| 5 |
| 11 |
点评:本题考查化学平衡移动与化学计算,题目难度中等,是对知识的综合运用,需要学生具备扎实的基础知识与运用知识分析问题、解决问题的能力,清楚左右两室的温度、压强相同,体积之比等于物质的量之比是解题关键.

练习册系列答案
相关题目
等量镁铝合金粉末分别与下列4种过量的溶液充分反应,放出H2最多的是( )
| A、2mol/L H2SO4溶液 |
| B、3mol/L CuSO4溶液 |
| C、6mol/L KOH溶液 |
| D、3mol/L Ba(OH)2溶液 |
现有三组溶液,汽油和水的混合物;汽油和柴油的混合物;氯化钠和单质碘的水溶液,分离以上各混合物的正确方法依次是( )
| A、分液、蒸馏、萃取 |
| B、萃取、蒸馏、分液 |
| C、分液、萃取、蒸馏 |
| D、蒸馏、萃取、分液 |
下列叙述错误的是( )
| A、乙烯和苯都能使溴水褪色,褪色的原因相同 |
| B、红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物结构的分析 |
| C、煤油可由石油分馏获得,可用作燃料和保存少量金属钠 |
| D、乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 |
实验是化学研究的基础.下列对实验现象的描述错误的是( )
 |  | 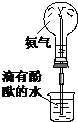 |  |
| ① | ② | ③ | ④ |
| A、实验①中溶液变黄色 |
| B、实验②试管中混合溶液变红色 |
| C、实验③中烧瓶内溶液变红色 |
| D、实验④中出现砖红色沉淀 |

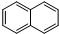 )的衍生物;
)的衍生物;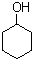 为原料制备化合物B的合成路线流程图(无机试剂任选).合成路线流程图示例如下:H2C═CH2
为原料制备化合物B的合成路线流程图(无机试剂任选).合成路线流程图示例如下:H2C═CH2
