题目内容
9.下列物质与溴水混合振荡,溶液分层且上层有色、下层无色的是( )| A. | 己烯 | B. | 甲苯 | C. | 乙醇 | D. | 四氯化碳 |
分析 与溴水混合振荡,溶液分层且上层有色、下层无色,则有机物不溶于水,且密度比水的小,以此来解答.
解答 解:A.己烯与溴水发生加成反应,溶液褪色,故A不选;
B.甲苯与溴水混合振荡,溶液分层且上层有色、下层无色,故B选;
C.乙醇与溴水互溶,故C不选;
D.四氯化碳与溴水混合振荡,溶液分层且下层有色、上层无色,故D不选;
故选B.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、混合物分离方法为解答本题的关键,侧重分析与应用的考查,注意有机物性质的应用,题目难度不大.

练习册系列答案
相关题目
19.25℃时,下列有关电解质溶液说法正确的是( )
| A. | 稀醋酸中加入冰醋酸,醋酸电离平衡右移,电离度增大 | |
| B. | 向NaF溶液中滴加硫酸至中性时,c(SO42-)<c(HF) | |
| C. | 向氨水中加入NH4C1固体,溶液中$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}{c(N{H}_{4}^{+})}$增大 | |
| D. | AgCl在水和NaCl溶液中的溶度积分别为K1、K2,则K1>K2 |
20.过氧化钠是一种制氧剂,它和二氧化碳反应方程式为:2Na2O2+2CO2→2Na2CO3+O2下列说法正确的是( )
| A. | Na2O2是氧化剂,CO2是还原剂 | |
| B. | Na2CO3是还原产物,O2是氧化产物 | |
| C. | 每转移4摩尔电子,有1摩尔氧气生成 | |
| D. | 1摩尔CO2参加反应就会产生11.2LO2 |
17.反应A2(g)+B2(g)→2AB(g)的能量变化如图所示,叙述正确的是( )
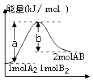

| A. | 该反应是放热反应 | |
| B. | 加入催化剂,(b-a)的差值减小 | |
| C. | 每生成2molAB分子吸收bkJ热量 | |
| D. | 若反应生成AB为液态,吸收的热量小于(a-b)kJ |
4.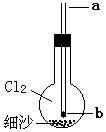 如图烧瓶内充满氯气,底部有层细沙(不参与反应),b处塞有小块钠.从a口用细铁丝把钠送下去,再从a口滴下一滴水,恰好滴在钠块上,立即剧烈反应,烧瓶内产生大量白色烟雾.不正确的说法是( )
如图烧瓶内充满氯气,底部有层细沙(不参与反应),b处塞有小块钠.从a口用细铁丝把钠送下去,再从a口滴下一滴水,恰好滴在钠块上,立即剧烈反应,烧瓶内产生大量白色烟雾.不正确的说法是( )
 如图烧瓶内充满氯气,底部有层细沙(不参与反应),b处塞有小块钠.从a口用细铁丝把钠送下去,再从a口滴下一滴水,恰好滴在钠块上,立即剧烈反应,烧瓶内产生大量白色烟雾.不正确的说法是( )
如图烧瓶内充满氯气,底部有层细沙(不参与反应),b处塞有小块钠.从a口用细铁丝把钠送下去,再从a口滴下一滴水,恰好滴在钠块上,立即剧烈反应,烧瓶内产生大量白色烟雾.不正确的说法是( )| A. | 水可能参与二个氧化还原反应 | |
| B. | Cl2可能参与四个氧化还原反应 | |
| C. | 氧元素参与的反应一定是氧化还原反应 | |
| D. | 氢元素参与的反应包含被氧化与被还原过程 |
14.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,22.4 L氩气约含2 NA个氩原子 | |
| B. | 14 g乙烯和丙烯混合气体中含有2 NA个氢原子 | |
| C. | 标准状况下,2.24 L CCl4含有0.4 NA根共价键 | |
| D. | 1 mol N2与3 mol H2充分反应,生成2 NA个NH3分子 |
1.用饱和氯化钠溶液润湿的滤纸分别做甲、乙两个实验,下列判断错误的是( )

| A. | 甲是原电池,乙是电解池 | |
| B. | 甲中铁棒比乙中铁棒更易腐蚀 | |
| C. | d电极上的电极反应是:Fe-2e→Fe2+ | |
| D. | b电极上的电极反应是:O2+2H2O+4e→4OH- |
18.检验苯甲醛中是否含有苯甲醇可用的试剂是( )
| A. | 金属钠 | B. | 银氨溶液 | C. | 新制氢氧化铜 | D. | 饱和食盐水 |
19.在相同温度时100mL 0.01mol/L的醋酸溶液与10mL 0.1mol/L的醋酸溶液相比较,下列数值前者大于后者的是( )
| A. | 完全中和所需NaOH的量 | B. | CH3COOH的电离程度 | ||
| C. | 溶液中H+的物质的浓度 | D. | CH3COOH的物质的量 |