题目内容
7.表示下列氧化还原反应中电子转移的情况(用双线桥或单线桥法)(1)2FeCl3+2KI=2FeCl2+2KCl+I2
氧化剂:FeCl3,还原产物:FeCl2
(2)H2S+H2SO4(浓)=S↓+SO2+2H2O
还原剂:H2S.
分析 (1)2FeCl3+2KI=2FeCl2+2KCl+I2中,铁元素化合价从+3价变化为+2价得到电子;碘元素化合价从-1价变化为0价;
(2)H2S+H2SO4(浓)=S↓+SO2↑+2H2O中,化合价的变化为:H2S→S,S元素由-2价→0价,一个H2S分子失去2个电子,所以H2S是还原剂;S是氧化产物;H2SO4→SO2,S元素由+6价→+4价,一个H2SO4分子得2个电子,该反应中转移电子数为2,以此来解答.
解答 解:(1)铁元素化合价从+3价变化为+2价得到电子,氧化剂是FeCl3,对应产物FeCl2还原产物;碘元素化合价从-1价变化为0价,用双线桥标注电子转移方向和数目为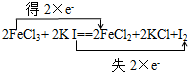 ,故答案为:
,故答案为: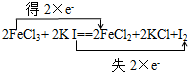 ;FeCl3;FeCl2;
;FeCl3;FeCl2;
(2)H2S+H2SO4(浓)=S↓+SO2↑+2H2O中,化合价的变化为:H2S→S,S元素由-2价→0价,还原剂是H2S,一个H2S分子失去2个电子,所以H2S是还原剂;S是氧化产物;H2SO4→SO2,S元素由+6价→+4价,一个H2SO4分子得2个电子,该反应中转移电子数为2,用双线桥标注电子转移方向和数目为: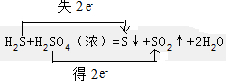 ,
,
故答案为: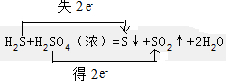 ;H2S.
;H2S.
点评 本题考查氧化还原反应中转移电子数的考查,为高频考点、把握元素的化合价变化、得失电子的方向为解答的关键,注意箭头指向与转移电子总数,题目难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
17.分子式为C8H16O2的有机物A能在酸性条件下水解生成有机物B和C,且B在一定条件下能转化为C,则有机物A可能的结构有( )
| A. | 1 种 | B. | 2 种 | C. | 3 种 | D. | 4 种 |
18.对下列物质性质或用途的描述不符合事实的是( )
| A. | 氯水用于漂白表现了HClO的强氧化性 | |
| B. | 将一小块金属钠投入稀硫酸铜溶液中会有红色固体析出 | |
| C. | 过氧化钠可用作呼吸面具中的供氧剂 | |
| D. | 等质量的Na2CO3和NaHCO3两种固体,分别与过量盐酸反应,NaHCO3生成CO2的质量比较多 |
15.在t℃时,将a gNH3完全溶解于水,得到VmL溶液.假设该溶液的密度为ρ g•cm-3,质量分数为ω,其中含NH4+的物质的量为b mol.下列叙述正确的是( )
| A. | 溶质的质量分数ω=$\frac{a}{Vρ-a}$×100% | |
| B. | 溶质的物质的量浓度c=$\frac{1000a}{17V}$mol/L | |
| C. | 溶液中c(OH-)=$\frac{1000b}{V}$mol/L | |
| D. | 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω |
12.在一定温度下,体积不变的密闭容器中可逆反应A(g)+3B(g)?2C(g) 达到平衡的标志是( )
| A. | 气体的密度不再变化 | |
| B. | A、B、C的浓度之比为1:3:2 | |
| C. | A、B、C的浓度不再变化 | |
| D. | 单位时间内生成n molA,同时生成3n molB |
16.自来水可以用氯气消毒.某学生用这种自来水去配制下列物质的溶液,不会产生明显的变质问题的是( )
| A. | 硝酸银 | B. | 氯化亚铁 | C. | 亚硫酸钠 | D. | 氯化铝 |
17.已知下列元素的原子半径如表所示,根据以下数据,磷原子半径可能是( )


| A. | 0.70×10-10m | B. | 0.80×10-10m | C. | 1.10×10-10m | D. | 1.20×10-10m |

 A、B、C、D、E五种周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物的水化物与其氢化物能相互反应生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的$\frac{3}{4}$,A、B、D、E这四种元素,每一种与C元素都形成元素的原子个数比不相同的若干种化合物.请回答下列问题:
A、B、C、D、E五种周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物的水化物与其氢化物能相互反应生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的$\frac{3}{4}$,A、B、D、E这四种元素,每一种与C元素都形成元素的原子个数比不相同的若干种化合物.请回答下列问题: