题目内容
12.伞形酮可由雷琐苯乙酮和苹果酸在一定条件下反应制得,下列说法正确的是( )
| A. | 雷琐苯乙酮中含有1个手性碳原子 | |
| B. | 雷琐苯乙酮不能与碳酸钠溶液反应 | |
| C. | 伞形酮和雷琐苯乙酮都能与FeCl3溶液发生显色反应 | |
| D. | 1 mol伞形酮与NaOH溶液反应,最多可消耗2 mol NaOH |
分析 A.结合手性碳原子的定义判断;
B.雷琐苯乙酮含有酚羟基,可与碳酸钠反应;
C.雷梭苯乙酮和伞形酮都含有酚羟基,均能跟FeCl3溶液发生显色反应;
D.伞形酮含有酯基、酚羟基,而酯基是羧酸与酚形成的,水解得到羧基、酚羟基,酚羟基、羧基都可与氢氧化钠反应.
解答 解:A.手性碳原子连接四个不同的原子或原子团,雷琐苯乙酮中不含手性碳原子,故A错误;
B.雷琐苯乙酮含有酚羟基,可与碳酸钠反应,故B错误;
C.雷梭苯乙酮和伞形酮都含有酚羟基,都能跟FeCl3溶液发生显色反应,故C正确;
D.伞形酮水解产物含有2个酚羟基和1个羧基,最多可消耗3mol NaOH,故D错误.
故选C.
点评 本题考查有机物的结构性质,为高频考点,把握官能团与性质的关系为解答的关键,选项A解答的易错点,注意手性碳原子的判断,题目难度中等.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
2.下列各组物质中,仅用水及物质间相互反应不能一一区别的一组是( )
| A. | Na2O2 Al2(SO4)3 MgCl2 K2CO3 | |
| B. | BaCl2 Na2SO4 (NH4)2SO4 KOH | |
| C. | AgNO3 NaCl KCl CuCl2 | |
| D. | Fe2(SO4)3 K2CO3 KHSO4 NH4Cl |
20.下列关于有机化合物的说法不正确的是( )
| A. | 淀粉和纤纤维素互为同分异构体 | |
| B. | 油脂在碱性条件下的水解反应称为皂化反应 | |
| C. | 分子式为C5H10O2的有机物中能与NaHCO3溶液反应的有4种 | |
| D. | 在加热条件下,用新制的氢氧化铜悬浊液可鉴别乙醇和葡萄糖 |
7.利用下列实验装置进行相应的实验,不能达到实验目的是( )

| A. | 利用图甲装置,可快速制取氨气 | |
| B. | 利用图乙装置,用饱和碳酸钠溶液分离CH3CH2OH和CH3COOC2H5混合液 | |
| C. | 利用图丙装置,可制取乙烯并验证其易酸性KMnO4溶液氧化 | |
| D. | 利用图丁装置,可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 |
17.实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是( )
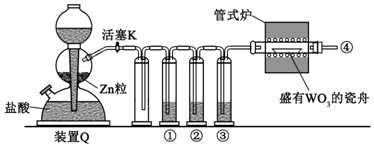

| A. | ①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液 | |
| B. | 管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体浓度 | |
| C. | 结束反应时,先关闭活塞K,再停止加热 | |
| D. | 装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气 |
3.下列说法不正确的是( )
| A. | 1mol 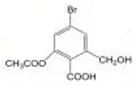 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,最多消耗这三种物质的物质的量分别是2mol、5mol、1mol 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,最多消耗这三种物质的物质的量分别是2mol、5mol、1mol | |
| B. | CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用1H-NMR来鉴别 | |
| C. | 乳酸薄荷醇酯(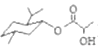 )仅能发生水解、氧化、消去反应 )仅能发生水解、氧化、消去反应 | |
| D. | 与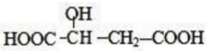 具有官能团种类及数目相同的同分异构体有2种 具有官能团种类及数目相同的同分异构体有2种 |
20. 常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示.下列叙述错误的是( )
常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示.下列叙述错误的是( )
 常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示.下列叙述错误的是( )
常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示.下列叙述错误的是( )| A. | Ka2(H2X)的数量级为10-6 | |
| B. | 曲线N表示pH与lg$\frac{c(H{X}^{-})}{c({H}_{2}X)}$的变化关系 | |
| C. | NaHX溶液中c(H+)>c(OH-) | |
| D. | 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+) |
15.某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下.
向硝酸酸化的0.05mol•L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色.
(1)检验产物
①取少量黑色固体,洗涤后,加入足量加入足量稀盐酸(或稀硫酸)酸化,固体未完全溶解(填操作和现象),证明黑色固体中含有Ag.
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有Fe2+.
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是Fe+2Fe3+=3Fe2+(用离子方程式表示).针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测.同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
(资料:Ag+与SCN-生成白色沉淀AgSCN)
②对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于4Fe2++O2+4H+=4Fe3++2H2O(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+;
假设d:根据白色沉淀现象,判断溶液中存在Ag+,可产生Fe3+.
③下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因.实验Ⅱ可证实假设d成立.
实验Ⅰ:向硝酸酸化的NaNO3溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3min时溶液呈浅红色,30min后溶液几乎无色.
实验Ⅱ:装置如图.其中甲溶液是FeCl2/FeCl3,操作及现象是按图连接好装置,电流表指针发生偏转.
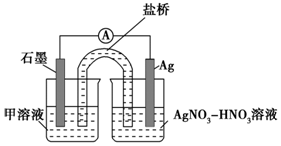
(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因:i→ii Ag++Fe2+=Ag+Fe3+,反应生成Fe3+的使Fe3+增加,红色变深,ii→iii 空气中氧气氧化SCN-,红色变浅.
向硝酸酸化的0.05mol•L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色.
(1)检验产物
①取少量黑色固体,洗涤后,加入足量加入足量稀盐酸(或稀硫酸)酸化,固体未完全溶解(填操作和现象),证明黑色固体中含有Ag.
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有Fe2+.
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是Fe+2Fe3+=3Fe2+(用离子方程式表示).针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测.同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
| 序号 | 取样时间/min | 现象 |
| ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
| ⅱ | 30 | 产生白色沉淀;较3min时量少;溶液红色较3min时加深 |
| ⅲ | 120 | 产生白色沉淀;较30min时量少;溶液红色较3 0min时变浅 |
②对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于4Fe2++O2+4H+=4Fe3++2H2O(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+;
假设d:根据白色沉淀现象,判断溶液中存在Ag+,可产生Fe3+.
③下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因.实验Ⅱ可证实假设d成立.
实验Ⅰ:向硝酸酸化的NaNO3溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3min时溶液呈浅红色,30min后溶液几乎无色.
实验Ⅱ:装置如图.其中甲溶液是FeCl2/FeCl3,操作及现象是按图连接好装置,电流表指针发生偏转.

(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因:i→ii Ag++Fe2+=Ag+Fe3+,反应生成Fe3+的使Fe3+增加,红色变深,ii→iii 空气中氧气氧化SCN-,红色变浅.
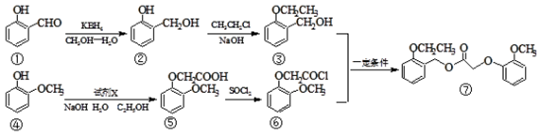
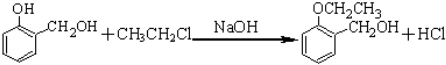 .
.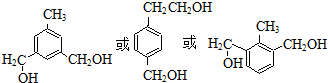 (写出一种
(写出一种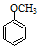 +HBr→
+HBr→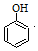 +CH3Br
+CH3Br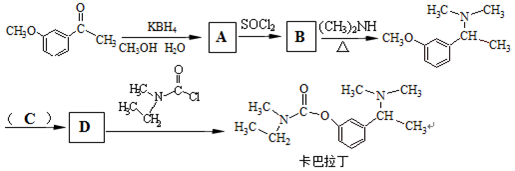
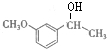 B:
B: C:HBrD:
C:HBrD: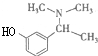 .
.