题目内容
某爆鸣气中H2和O2的质量分数分别为75%和25%,则该爆鸣气对氢气的相对密度是 .
考点:化学方程式的有关计算
专题:计算题
分析:根据n=
计算氢气、氧气的物质的量之比,再根据M=
计算混合气体的平均摩尔质量,而相同条件下气体的摩尔质量之比等于密度之比,以此解答该题.
| m |
| M |
| m |
| n |
解答:
解:n(H2):n(O2)=
:
=48:1,
则平均摩尔质量为
g/mol=2.6g/mol
则该爆鸣气对氢气的相对密度是
=1.3,
故答案为:1.3.
| 75% |
| 2 |
| 25% |
| 32 |
则平均摩尔质量为
| 48×2+1×32 |
| 48+1 |
则该爆鸣气对氢气的相对密度是
| 2.6g/mol |
| 2g/mol |
故答案为:1.3.
点评:本题考查物质的量有关计算,难度不大,注意掌握以物质的量为中心的有关计算.

练习册系列答案
相关题目
在标准状况下,将NO、NO2、O2混合后,充满容器倒置于H2O中,完全溶解,无气体剩余.若产物也不扩散,则所得溶液物质的量浓度(c)数值范围是( )
A、0<c<
| ||||
B、
| ||||
C、
| ||||
D、
|
在如图所示的两个电化学装置中,连接灵敏电流计的并接通电路,两个电流计的指针均明显 偏转,下列说法错误的是( )
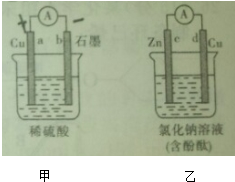

| A、甲溶液中H+的移动方向是a→b |
| B、b电极上的电极反应式为:2H++2e-═H2↑ |
| C、一段时间后,d电极附近的溶液变红 |
| D、乙装置中的溶液会逐渐变浑浊 |
以NA代表阿伏罗德常数,则下列关于热化学方程式:
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=-1300kJ?mol-1的说法正确的是( )
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=-1300kJ?mol-1的说法正确的是( )
| A、有10NA个电子转移时,该反应吸收1300kJ的能量 |
| B、有NA个水分子生成且为液体时,吸收1300kJ的能量 |
| C、有2NA个碳氧共用电子对生成时,放出1300kJ的能量 |
| D、有8NA个碳氧共用电子对生成时,放出1300kJ的能量 |
下列叙述中,能证明某物质是弱电解质的是( )
| A、熔化时不导电 |
| B、不是离子化合物,而是极性共价化合物 |
| C、溶液中已电离的离子和未电离的分子共存 |
| D、水溶液的导电能力很差 |
 纳米级Cu2O由于具有优良的催化性能而受到关注.采用离子交换膜控制电解液中OH一的浓度制备纳米级Cu2O的装置如图所示,发生的反应为:2Cu+H2O
纳米级Cu2O由于具有优良的催化性能而受到关注.采用离子交换膜控制电解液中OH一的浓度制备纳米级Cu2O的装置如图所示,发生的反应为:2Cu+H2O
| ||
| A、钛电极发生氧化反应 |
| B、阳极附近溶液的pH逐渐增大 |
| C、离子交换膜应采用阳离子交换膜 |
| D、阳极反应式是:2Cu+2OH一一2e一═Cu2O+H2O |
下列关于氯水的叙述,正确的是( )
| A、新制氯水中只含Cl2和H2O分子 |
| B、新制氯水可使蓝色石蕊试纸变红且不褪色 |
| C、光照氯水有气泡逸出,该气体是Cl2 |
| D、氯水放置数天后pH将变小 |