题目内容
一定温度下,向0.1mol/LNaC1O溶液中分别加入少量下列固体(忽略溶液体积变化),可使c(C1O-)增大的是( )
| A、NaOH |
| B、NH4NO3 |
| C、Na2SO3 |
| D、FeC12 |
考点:影响盐类水解程度的主要因素
专题:盐类的水解专题
分析:NaC1O溶液中存在C1O-+H2O?HC1O+OH-,要使c(C1O-)增大,平衡逆向移动,由此分析解题.
解答:
解:A、加氢氧化钠,氢氧根离子浓度变大,平衡逆向移动,c(C1O-)增大,故A正确;
B、加NH4NO3,铵根离子与次氯酸根离子水解相互促进,平衡正向移动,c(C1O-)减小,故B错误;
C、加Na2SO3,发生氧化还原反应,c(C1O-)减小,故C错误;
D、加FeC12,发生氧化还原反应,c(C1O-)减小,故D错误;
故选:A.
B、加NH4NO3,铵根离子与次氯酸根离子水解相互促进,平衡正向移动,c(C1O-)减小,故B错误;
C、加Na2SO3,发生氧化还原反应,c(C1O-)减小,故C错误;
D、加FeC12,发生氧化还原反应,c(C1O-)减小,故D错误;
故选:A.
点评:本题考查水解平衡移动的相关知识,结合氧化还原反应的知识考查,综合性强,难度中等.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
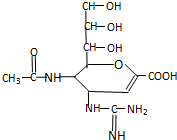 已知扎那米韦是流感病毒神经氨酸酶抑制剂,其对流感病毒的抑制是以慢结合的方式进行的,具有高度特异性.其分子结构如图:下列说法正确的是( )
已知扎那米韦是流感病毒神经氨酸酶抑制剂,其对流感病毒的抑制是以慢结合的方式进行的,具有高度特异性.其分子结构如图:下列说法正确的是( )| A、该物质的分子式为C12H19N4O7 |
| B、在一定条件下,该物质可以发生消去、加成、取代等反应 |
| C、1mol该物质与NaOH溶液反应,可以消耗4molNaOH |
| D、该物质能使溴水或高锰酸钾溶液褪色,能与FeCl3溶液发生显色反应 |
下列物质是生活中常见的物质,属于强电解质的是( )
| A、干冰 |
| B、BaSO4 |
| C、醋酸 |
| D、酒精 |
在锌与盐酸的反应中,HCl( )
| A、发生氧化反应 | B、是还原剂 |
| C、是氧化剂 | D、表现还原性 |
 煤间接液化是煤化工的一种重要方法:首先将原料煤与氧气、水蒸汽反应将煤全部气化,制得的粗煤气经变换、脱硫、脱碳制成洁净的合成气(CO+H2),然后合成气在催化剂作用下发生合成反应生成烃类,如:[nCO+(2n+1)H2=CnH2n+2+nH2O];或者合成醇类,如合成甲醇:CO(g)+2H2(g)?CH3OH(g).等等.
煤间接液化是煤化工的一种重要方法:首先将原料煤与氧气、水蒸汽反应将煤全部气化,制得的粗煤气经变换、脱硫、脱碳制成洁净的合成气(CO+H2),然后合成气在催化剂作用下发生合成反应生成烃类,如:[nCO+(2n+1)H2=CnH2n+2+nH2O];或者合成醇类,如合成甲醇:CO(g)+2H2(g)?CH3OH(g).等等. A、B、C、D、E五种元素均为短周期元素,原子序数逐渐增大,A元素原子的核外电子数、电子层数和最外层电子数均相等.B、C、D、E三种元素在周期表中相对位置如表,只有E元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、C、D三种元素中的若干种组成(只有M分子同时含有三种元素),其中甲、乙为非金属单质,W由A和C组成,分子中含有18个电子,X分子含有10个电子,它们之间的相互转化关系如图:
A、B、C、D、E五种元素均为短周期元素,原子序数逐渐增大,A元素原子的核外电子数、电子层数和最外层电子数均相等.B、C、D、E三种元素在周期表中相对位置如表,只有E元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、C、D三种元素中的若干种组成(只有M分子同时含有三种元素),其中甲、乙为非金属单质,W由A和C组成,分子中含有18个电子,X分子含有10个电子,它们之间的相互转化关系如图: