题目内容
19.硫代硫酸钠俗称保险粉,又名“大苏打”.可用于照相业作定影剂、纸浆漂白作脱氯剂,也可用于氰化物、砷、汞、铅、铋、碘等中毒的治疗,也是一种常用的实验试剂.I.已知:Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O,某研究小组依据该反应探究外界条件对反应速率的影响,设计实验如下:
| 实验 编号 | 实验温度 /℃ | Na2S2O3 | H2SO4 | 蒸馏水体积 /mL | ||
| 体积/mL | 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | |||
| ① | 25 | 10 | 0.1 | 10 | 0.1 | 0 |
| ② | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| ③ | 25 | 5 | 0.2 | 10 | 0.2 | 5 |
| ④ | 50 | 5 | 0.1 | 10 | 0.1 | 5 |
| ⑤ | 50 | 10 | 0.2 | 5 | 0.2 | 5 |
A.实验①和②究其他条件不变时Na2S2O3浓度对相关反应速率的影响
B.实验①和③溶液变浑浊的时间相同
C.其他条件不变时,探究温度对化学反应速率的影响,应选择实验③和⑤
D.该同学在实验中采用的研究方法是实验比较法.
分析 从表中数据可知,实验的温度有25℃和50℃两种,每次实验的总体积都是20mL,所以本实验可以探究两个外界条件对反应速率的影响,即温度和浓度,探究温度对化学反应速率的影响,应选择浓度相同条件下的实验,要探究浓度对化学反应速率的影响,应选择温度相同条件下的实验,据此解答.
解答 解:从表中数据可知,实验的温度有25℃和50℃两种,每次实验的总体积都是20mL,所以本实验可以探究两个外界条件对反应速率的影响,即温度和浓度,探究温度对化学反应速率的影响,应选择浓度相同条件下的实验,要探究浓度对化学反应速率的影响,应选择温度相同条件下的实验,
A.实验①和②的温度相同,取用硫酸的物质的量一致,而Na2S2O3物质的量不同,由于溶液总体积都是20mL,所以硫酸的浓度相同,Na2S2O3浓度不同,所以实验①和②是探究其他条件不变时,Na2S2O3浓度对相关反应速率的影响,故A正确;
B.实验①和③的温度相同,③反应物Na2S2O3的浓度是相同的,但H2SO4的浓度更大,浓度越大,反应速率越快,出现浑浊的时间越短,所以实验③先浑浊,故B错误;
C.探究温度对化学反应速率的影响,应选择浓度相同条件下的实验,③和⑤中反应物的浓度混合前是一样的,由于用量不同,混合后总体积一样,所以在反应时反应物的浓度是不一样的,温度不同,浓度也不同,故C错误;
D.该同学在实验中采用的研究方法是控制变量法,即实验比较法,故D正确;
故选AD.
点评 本题考查外界条件对化学反应速率的影响,探究单一条件对速率的影响时,要让此条件成为唯一变量,注意在分析反应物浓度时总体积是20mL,反应物的浓度就与所取物质的量有关,整体难度适中.

练习册系列答案
相关题目
18.下列有关实验装置进行的相应实验,能达到实验目的是( )

| A. | 用图①所示装置制取少量纯净的乙烯气体 | |
| B. | 用图②所示装置制备Fe(OH)2并能保持长时间观察到白色 | |
| C. | 用图③所示装置制取并收集干燥纯净的Cl2 | |
| D. | 用图④所示装置制取NO并验证其性质 |
7.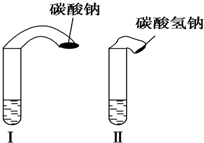 高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸(均足量)(只有浓度小于1mol•L-1的稀盐酸跟Na2CO3和NaHCO3反应才能根据反应的剧烈程度区分开来,浓度较高则反应现象都是同样的剧烈),将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上.将气球内的NaHCO3或NNa2CO3同时倒入试管中,观察到现象如下:
高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸(均足量)(只有浓度小于1mol•L-1的稀盐酸跟Na2CO3和NaHCO3反应才能根据反应的剧烈程度区分开来,浓度较高则反应现象都是同样的剧烈),将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上.将气球内的NaHCO3或NNa2CO3同时倒入试管中,观察到现象如下:
①试管中(填产生沉淀或气体及反应速率等相关现象)两支试管中都产生大量气泡,但盛NaHCO3的试管中反应速率要快得多;
②试管中气球大小(包含试管)体积之比约为(填最简单整数比)Ⅰ:Ⅱ=42:53;
③甲同学用手触摸试管,发现盛NaHCO3粉末的试管变凉,而盛Na2CO3粉末的试管温度有升高.由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应.
甲得出的结论是否正确不正确(填“正确”或“不正确”).
为研究是吸热反应还是放热反应,继续进行了下列实验(每次实验各做3次平行实验,取平均值):(注:每组固体全溶解且完全反应)
请你帮助填写相关内容:
(1)该研究报告的题目是《NaHCO3、Na2CO3和盐酸反应过程中热效应的研究》;
(2)该实验中所用的仪器除试管、药匙(或V形纸槽)、气球、下端带环状玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为托盘天平和温度计;
(3)通过上述实验可得出两条结论:
a.Na2CO3溶液和盐酸的反应是放热(吸热或放热)反应;
b.NaHCO3溶液和盐酸的反应是吸热(吸热或放热)反应.
 高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸(均足量)(只有浓度小于1mol•L-1的稀盐酸跟Na2CO3和NaHCO3反应才能根据反应的剧烈程度区分开来,浓度较高则反应现象都是同样的剧烈),将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上.将气球内的NaHCO3或NNa2CO3同时倒入试管中,观察到现象如下:
高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸(均足量)(只有浓度小于1mol•L-1的稀盐酸跟Na2CO3和NaHCO3反应才能根据反应的剧烈程度区分开来,浓度较高则反应现象都是同样的剧烈),将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上.将气球内的NaHCO3或NNa2CO3同时倒入试管中,观察到现象如下:①试管中(填产生沉淀或气体及反应速率等相关现象)两支试管中都产生大量气泡,但盛NaHCO3的试管中反应速率要快得多;
②试管中气球大小(包含试管)体积之比约为(填最简单整数比)Ⅰ:Ⅱ=42:53;
③甲同学用手触摸试管,发现盛NaHCO3粉末的试管变凉,而盛Na2CO3粉末的试管温度有升高.由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应.
甲得出的结论是否正确不正确(填“正确”或“不正确”).
为研究是吸热反应还是放热反应,继续进行了下列实验(每次实验各做3次平行实验,取平均值):(注:每组固体全溶解且完全反应)
| 序号 | 试剂1 | 试剂2 | 混合前 温度 | 混合后最高或 最低温度 |
| A | 50mL水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
| B | 50mL水 | 3.2g Na2CO3固体 | 20℃ | 23.3℃ |
| C | 50mL稀盐酸 | 2.5g NaHCO3固体 | 20℃ | 17.4℃ |
| D | 50mL稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 24.4℃ |
(1)该研究报告的题目是《NaHCO3、Na2CO3和盐酸反应过程中热效应的研究》;
(2)该实验中所用的仪器除试管、药匙(或V形纸槽)、气球、下端带环状玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为托盘天平和温度计;
(3)通过上述实验可得出两条结论:
a.Na2CO3溶液和盐酸的反应是放热(吸热或放热)反应;
b.NaHCO3溶液和盐酸的反应是吸热(吸热或放热)反应.
14.下列有关实验误差分析中,不正确的是( )
| A. | 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏大 | |
| C. | 用湿润的pH试纸测溶液的pH,测定值一定有误差 | |
| D. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测中和热的值偏小 |
4.烃A分子式为C4H10,分子结构中含有一个次甲基( ),则此物质A的二溴代物的种数为( )
),则此物质A的二溴代物的种数为( )
 ),则此物质A的二溴代物的种数为( )
),则此物质A的二溴代物的种数为( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 以上都不对 |
11.有关中和滴定有如下操作:①洗涤;②往滴定管内注入标准溶液;③滴定;④检查滴定管是否漏水;⑤用标准溶液润洗滴定管.其正确的操作顺序是( )
| A. | ⑤①②④③ | B. | ⑤①②④③ | C. | ⑤②①④③ | D. | ④①⑤②③ |
8.在一密闭容器中充入NO2,在一定条件下进行反应:2NO2?2NO+O2.达到平衡状态的标志是( )
| A. | NO2的消耗速率与NO的生成速率相等 | |
| B. | 容器内压强不随时间变化而变化 | |
| C. | NO2和O2的消耗速率之比为1:1 | |
| D. | 单位时间内生成2n mol NO.同时生成n mol O2 |
9.下列各物质中,所有原子或离子都满足最外层8电子结构的是( )
| A. | PCl5 | B. | BF3 | C. | BeCl2 | D. | NaClO |