题目内容
某待测液中可能含有Ag+、Fe3+、K+、Ba2+、NH4+、CO32-、NO3-、Cl-等离子,进行如下实验:
(1)加入过量的稀盐酸,有白色沉淀生成.
(2)过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成.
(3)过滤,取少量滤液,滴入2滴KSCN溶液,没有明显的现象出现.
(4)另取少量步骤(3)中的滤液,加入NaOH溶液至使溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体.根据实验现象回答:待测液中一定含有 离子,一定不含有 离子,还有一种离子不能确定是否存在,要检验这种离子的实验方法是(填写实验名称和观察到的现象,不要求写实验操作过程) .
(1)加入过量的稀盐酸,有白色沉淀生成.
(2)过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成.
(3)过滤,取少量滤液,滴入2滴KSCN溶液,没有明显的现象出现.
(4)另取少量步骤(3)中的滤液,加入NaOH溶液至使溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体.根据实验现象回答:待测液中一定含有
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:(1)加入过量的稀盐酸,有白色沉淀生成,说明原溶液中一定含有Ag+,一定不含Cl-;
(2)过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成,说明原溶液中一定含有Ba2+无CO32-;
(3)过滤,取少量滤液,滴入2滴KSCN溶液,没有明显的现象出现,说明溶液中一定不含Fe3+;
(4)少量步骤(3)中的滤液,加入NaOH溶液至使溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体,可知溶液中一定含有NH4+;
根据电荷守恒可判断,原溶液中一定存在NO3-;K+不能确定是否存在,K+的鉴定可通过焰色反应实现.
(2)过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成,说明原溶液中一定含有Ba2+无CO32-;
(3)过滤,取少量滤液,滴入2滴KSCN溶液,没有明显的现象出现,说明溶液中一定不含Fe3+;
(4)少量步骤(3)中的滤液,加入NaOH溶液至使溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体,可知溶液中一定含有NH4+;
根据电荷守恒可判断,原溶液中一定存在NO3-;K+不能确定是否存在,K+的鉴定可通过焰色反应实现.
解答:
解:(1)加入过量的稀盐酸,有白色沉淀生成,说明原溶液中一定含有Ag+,Ag+与Cl-反应生成氯化银沉淀,所以一定不含Cl-;
(2)滤液中加入过量的稀硫酸,又有白色沉淀生成,说明原溶液中一定有Ba2+与CO32-反应生成碳酸钡沉淀,所以一定不含CO32-;
(3)过滤,取少量滤液,滴入2滴KSCN溶液,没有明显的现象出现,说明溶液中一定不含Fe3+;
(4)少量步骤(3)中的滤液,加入NaOH溶液至使溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体,可知溶液中一定含有NH4+;
溶液呈电中性所以一定含有阴离子NO3-,
所以一定含有的离子有:Ag+、NO3-、NH4+、Ba2+;一定不含有的离子有:Fe3+、CO32-、Cl-;
K+不能确定是否存在.K+检验方法是焰色反应,透过透过蓝色钴玻璃观察,火焰呈紫色;
故答案为:Ag+、NO3-、NH4+、Ba2+;Fe3+、CO32-、Cl-;焰色反应,火焰呈紫色.
(2)滤液中加入过量的稀硫酸,又有白色沉淀生成,说明原溶液中一定有Ba2+与CO32-反应生成碳酸钡沉淀,所以一定不含CO32-;
(3)过滤,取少量滤液,滴入2滴KSCN溶液,没有明显的现象出现,说明溶液中一定不含Fe3+;
(4)少量步骤(3)中的滤液,加入NaOH溶液至使溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体,可知溶液中一定含有NH4+;
溶液呈电中性所以一定含有阴离子NO3-,
所以一定含有的离子有:Ag+、NO3-、NH4+、Ba2+;一定不含有的离子有:Fe3+、CO32-、Cl-;
K+不能确定是否存在.K+检验方法是焰色反应,透过透过蓝色钴玻璃观察,火焰呈紫色;
故答案为:Ag+、NO3-、NH4+、Ba2+;Fe3+、CO32-、Cl-;焰色反应,火焰呈紫色.
点评:本题考察离子的推断与检验,明确离子的性质和离子反应发生的条件是解题关键,题目难度不的,注意对基础知识的积累.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
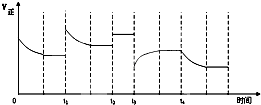 合成氨反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1,在反应过程中,正反应速率的变化如如图,下列说法正确的是( )
合成氨反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1,在反应过程中,正反应速率的变化如如图,下列说法正确的是( )| A、t1时增大了压强 |
| B、t2时同倍数增加N2、H2的物质的量 |
| C、t3时降低了温度 |
| D、t4时增大了c(NH3) |
下列关于有机物说法正确的是( )
| A、乙醇、乙醛和乙酸都可以与钠反应生成氢气 |
| B、蛋白质水解的最终产物是葡萄糖 |
| C、苯和乙烯都可以使溴的四氯化碳溶液反应褪色 |
| D、可用碘检验淀粉是否水解完全 |
下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的是( )
①NaHCO3 ②Al2O3③Al(OH)3 ④Al ⑤NaHSO4⑥AlCl3⑦NaAlO2.
①NaHCO3 ②Al2O3③Al(OH)3 ④Al ⑤NaHSO4⑥AlCl3⑦NaAlO2.
| A、①⑤ | B、②③④⑥⑦ |
| C、①②③④ | D、全部 |

 某学生设计一套实验装置如图所示,通过实验除去混在氮气中的氧气、二氧化碳、硫化氢和乙烯等气体,制得干燥的氮气.
某学生设计一套实验装置如图所示,通过实验除去混在氮气中的氧气、二氧化碳、硫化氢和乙烯等气体,制得干燥的氮气.