题目内容
4.设NA表示阿伏伽德罗常数的值,下列说法正确的是( )| A. | 17gOH-中所含电子数为10NA | |
| B. | Na2O2固体中的阳离子和阴离子个数比是1:1 | |
| C. | 9g重水(${\;}_{1}^{2}$D2O)所含有的电子数为5NA | |
| D. | 在标准状况下,11.2L氖气含有NA个氖原子 |
分析 A、1个OH-中含有10个电子,17gOH-的物质的量为1mol;
B、Na2O2固体中的阴离子和阳离子分别为Na+和O22-;
C、重水的摩尔质量为20g/mol,重水中含有10个电子;
D、根据n=$\frac{V}{Vm}$计算物质的量,结合氖气是单原子分子分析.
解答 解:A、1个OH-中含有10个电子,17gOH-的物质的量为1mol,所以17gOH-中所含电子数为10NA,故A正确;
B、Na2O2固体中的阴离子和阳离子分别为Na+和O22-,阳离子和阴离子个数比是2:1,故B错误;
C、9g重水的物质的量为0.45mol,含有4.5mol电子,含有的电子数为4.5NA,故C错误;
D、在标准状况下,11.2L氖气的物质的量=$\frac{11.2L}{22.4L/mol}$=0.5mol,氖气是单原子分子,11.2L氖气含有0.5NA个氖原子,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的应用,主要考查气体摩尔体积的条件应用,质量换算物质的量计算微粒数,物质的组成,题目难度中等.

练习册系列答案
相关题目
14.一定温度下,反应A2(气)+B2(气)?2AB(气)达到化学平衡状态的标志是( )
| A. | 单位时间生成 n mol 的 A2,同时生成 n mol 的 AB | |
| B. | 容器内的总压强不随时间的变化而变化 | |
| C. | 单位时间生成2n mol 的 AB,同时生成n mol 的 B2 | |
| D. | 单位时间生成n mol 的 A2,同时生成n mol 的 B2 |
15.由短周期主族元素X、Y、Z组成的单质(化学式也分别为X、Y、Z),X为金属,其核外电子数为Y原子序数的2倍,Y的最低负化合价与Z的最高正化合价的数值相等,甲、乙、丙、丁四种均为氧化物,甲和丁为无色的气体,晶体甲可用于人工降雨,乙和丙熔点均很高,且它们在一定条件下能发生如下反应,下列说法中正确的是( )
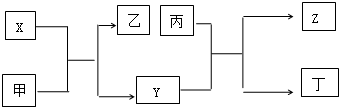

| A. | X为第三周期Π族元素,Y和Z位于不同主族 | |
| B. | 甲、乙、丙均能与水发生化合反应 | |
| C. | 晶体甲、乙、丙分别分子晶体、离子晶体和原子晶体 | |
| D. | X可用于制焰火烟花,丙可用于作太阳能电池的材料 |
12.下列装置或操作能达到实验目的是( )
| A. |  除去乙醇中的乙酸 | B. |  形成原电池 | ||
| C. | 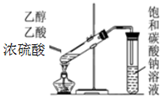 制取乙酸乙酯 | D. |  收集NH3 |
9.下列化学反应速率,前者一定大于后者的是( )
| A. | G+H=W,其它条件相同时,分别在200℃和100℃下进行反应 | |
| B. | 相同温度下,颗粒相同的锌粒分别与H+浓度相同的硫酸和盐酸反应 | |
| C. | A+B=C(500℃下进行) D+E=F(100℃下进行) | |
| D. | 相同温度下,锌粒与铁粉分别与同浓度的盐酸反应 |
16.目前,人类已经发现的非金属元素除稀有气体元素外共有16种,下列对这16种非金属元素的判断不正确的是( )
①都是主族元素,原子的最外层电子数都大于3
②单质在反应中都只能作氧化剂
③对应的含氧酸都是强酸
④氢化物常温下都是气态,所以又叫气态氢化物
⑤气态氧化物与水反应都不会再生成气体.
①都是主族元素,原子的最外层电子数都大于3
②单质在反应中都只能作氧化剂
③对应的含氧酸都是强酸
④氢化物常温下都是气态,所以又叫气态氢化物
⑤气态氧化物与水反应都不会再生成气体.
| A. | 只有①②④⑤ | B. | 全部 | C. | 只有①② | D. | 只有①②③④ |
13.下列说话正确的是( )
| A. | 构成单质分子的粒子一定含共价键 | |
| B. | 非金属元素组成的化合物一定不是离子化合物 | |
| C. | 第ⅠA族和第ⅦA族原子化合时一定形成离子键 | |
| D. | 共价化合物中一定不含离子键 |
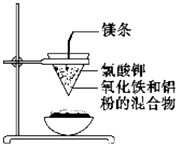 如图所示:用两张圆形滤纸分别折叠成漏斗状,套在一起,使四周都有四层.把内层滤纸取出,在底部剪一个小孔,用水润湿,再跟另一纸漏斗套在一起,架在铁圈上,下面放置一盛沙的蒸发皿.把5g干燥的氧化铁粉末和2g铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条.观察发生的现象.通过以上实验信息,回答下列问题:
如图所示:用两张圆形滤纸分别折叠成漏斗状,套在一起,使四周都有四层.把内层滤纸取出,在底部剪一个小孔,用水润湿,再跟另一纸漏斗套在一起,架在铁圈上,下面放置一盛沙的蒸发皿.把5g干燥的氧化铁粉末和2g铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条.观察发生的现象.通过以上实验信息,回答下列问题: