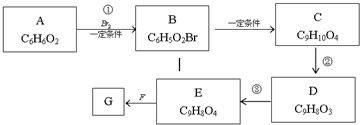
题目内容
制备纳米Fe3O4的过程如下:下列有关叙述不合理的是( )


| A、纳米Fe3O4分散在适当溶剂中,当强光照射时,会产生丁达尔现象 |
| B、反应①的反应类型为消去反应 |
| C、反应②中,环丙胺的作用可能是促进氯化铁水解 |
| D、反应③的化学方程式为:6FeOOH+CO═2Fe3 O4+3H2O+CO2 |
考点:纳米材料
专题:化学应用
分析:A、利用胶体的性质来分析;
B、根据消去反应的定义来分析;
C、根据反应②环丙胺没有参加反应来分析.
D、根据反应③中的反应物与生成物及质量守恒定律来分析.
B、根据消去反应的定义来分析;
C、根据反应②环丙胺没有参加反应来分析.
D、根据反应③中的反应物与生成物及质量守恒定律来分析.
解答:
解:A、纳米四氧化三铁分散在适当分散剂中,属于胶体分散系,则具有丁达尔现象,故A正确;
B、消去反应是指一定条件下,有机物分子里生成小分子.同时生成不饱和有机物的反应,故反应①不是消去反应,故B错误;
C、因反应②环丙胺不参加反应,但加快反应速率,即加快了氯化铁水解,故C正确;
D、由制备过程图可知,反应③的反应物为FeOOH和CO,由一种生成物为Fe3O4和质量守恒定律可知反应为6FeOOH+CO═2Fe3O4+3H2O+CO2,故D正确;
故选B.
B、消去反应是指一定条件下,有机物分子里生成小分子.同时生成不饱和有机物的反应,故反应①不是消去反应,故B错误;
C、因反应②环丙胺不参加反应,但加快反应速率,即加快了氯化铁水解,故C正确;
D、由制备过程图可知,反应③的反应物为FeOOH和CO,由一种生成物为Fe3O4和质量守恒定律可知反应为6FeOOH+CO═2Fe3O4+3H2O+CO2,故D正确;
故选B.
点评:本题属于信息习题,学生应注重习题信息和所学知识相结合来解答本题,并注意质量守恒定律、胶体的性质等来解答.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
几种短周期元素的原子半径及主要化合价如表:下列叙述错误的是( )
| 元素代号 | L | M | X | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 |
| A、R的氧化物对应的水化物可能具有两性 |
| B、X单质在氧气中燃烧不可能生成XO3 |
| C、离子半径大小:r(M3+)>r(T2-) |
| D、L2+和X2-的核外电子数相等 |
下列关于氧化还原反应实质的说法中,比较确切的是( )
| A、有电子转移 |
| B、有电子得失 |
| C、得氧或失氧 |
| D、有元素化合价变化 |
下列物质中,属于共价化合物的是( )
| A、NH3 |
| B、Na2O |
| C、CaCl2 |
| D、MgO |
同温同压下,两个相同容积的容器中,一个盛有NO气体,另一个盛有N2和O2的混合气体,则两容器内的气体一定具有相同的( )
①分子数②原子数③质子数④质量⑤密度⑥物质的量.
①分子数②原子数③质子数④质量⑤密度⑥物质的量.
| A、①② | B、②③⑤ |
| C、②③⑥ | D、①②⑥ |
NA表示阿佛加德罗常数,下列说法不正确的是( )
| A、9gD2O所含有的质子数为5NA |
| B、100mL1mol?L-1AlCl3溶液中含的阳离子数大于0.1NA |
| C、25℃时,pH=12的1.0 L NaClO溶液中水电离出的OH-的数目为0.01 NA |
| D、7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA |
根据下面的物质转换图,下列说法不正确的是( )
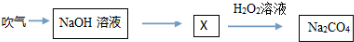

| A、Na2CO4是一种盐,其中碳为+6价 |
| B、X溶液中可能含两种盐 |
| C、该过程中没有发生氧化还原反应 |
| D、NaHCO3与盐酸和氢氧化钠均能反应 |
 碳及其化合物在人类生产、生活中的应用非常广泛.“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.
碳及其化合物在人类生产、生活中的应用非常广泛.“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.