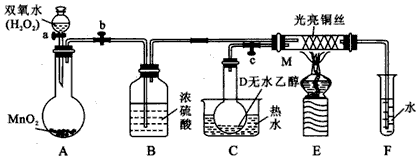
题目内容
3. 取一定量的铁粉与2mol•L-1稀硝酸400mL反应,反应后硝酸和铁均无剩余(铁只显+2价),且硝酸的还原产物只有NO.(不考虑溶液体积的变化)
取一定量的铁粉与2mol•L-1稀硝酸400mL反应,反应后硝酸和铁均无剩余(铁只显+2价),且硝酸的还原产物只有NO.(不考虑溶液体积的变化)①若将铁粉慢慢加入到稀硝酸中,并搅拌,反应过程中溶液里Fe3+、H+、
NO3ˉ 三种离子中的某离子的物质的量的变化曲线如图所示,则该曲线表示的是NO3-物质的量变化.
②若图中,当反应消耗0.2mol铁时,所需时间为2分钟,则H+离子的反应速率为1.0mol•L-1•min-1.
分析 ①最初NO3-为0.8mol,故图中曲线表示NO3-物质的量的变化;
②由图可知,当反应消耗0.2mol铁时,发生Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,据v(H+)=$\frac{\frac{△n}{V}}{△t}$分析计算.
解答 解:①图象分析可知纵轴0.8到0.6后不再变化,氢离子全部变化为水,所以最初NO3-物质的量=2mol•L-1×0.400L=0.8mol,故图中曲线表示NO3-物质的量的变化,
故答案为:NO3-;
②当反应消耗0.2mol铁时,发生反应:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,0.2mol到0.3mol是发生反应:Fe+2Fe(NO3)3=3Fe(NO3)2,消耗硝酸物质的量为0.8mol,消耗氢离子为0.8mol,v(H+)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.8mol}{0.4L}}{2min}$=1.0 mol•L-1•min-1,
故答案为:1.0.
点评 本题考查了氧化还原反应中电子守恒的应用、图象的分析判断和反应的定量计算,题目难度不大.

练习册系列答案
相关题目
14.在饱和的氯水中还可以大量存在的离子是( )
| A. | I- | B. | HCO3- | C. | SO42- | D. | Fe2+ |
2. 已知:pKa=-lgKa,25℃时,H2A的pKal=1.85,pKa2=7.19.常温下,用0.1mol•L-1NaOH溶液滴定20mL 0.1mol•L-1H2A溶液的滴定曲线如图所示.下列说法正确的是( )
已知:pKa=-lgKa,25℃时,H2A的pKal=1.85,pKa2=7.19.常温下,用0.1mol•L-1NaOH溶液滴定20mL 0.1mol•L-1H2A溶液的滴定曲线如图所示.下列说法正确的是( )
 已知:pKa=-lgKa,25℃时,H2A的pKal=1.85,pKa2=7.19.常温下,用0.1mol•L-1NaOH溶液滴定20mL 0.1mol•L-1H2A溶液的滴定曲线如图所示.下列说法正确的是( )
已知:pKa=-lgKa,25℃时,H2A的pKal=1.85,pKa2=7.19.常温下,用0.1mol•L-1NaOH溶液滴定20mL 0.1mol•L-1H2A溶液的滴定曲线如图所示.下列说法正确的是( )| A. | a点所得溶液中:V0=10 mL | |
| B. | b点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-) | |
| C. | c点所得溶液中:c(A2-)=c(HA-) | |
| D. | d点所得溶液中A2-水解平衡常数Khl=10-7.19 |
9. 近年来甲醇用途日益广泛,越来越引起商家的关注,工业上甲醇的合成途径多种多样.现有实验室中模拟甲醇合成反应,在2L密闭容器内,400℃时反应:CO(g)+2H2(g)?CH3OH(g)△H<0,体系中n(CO)随时间的变化如表:
近年来甲醇用途日益广泛,越来越引起商家的关注,工业上甲醇的合成途径多种多样.现有实验室中模拟甲醇合成反应,在2L密闭容器内,400℃时反应:CO(g)+2H2(g)?CH3OH(g)△H<0,体系中n(CO)随时间的变化如表:
(1)图1中表示CH3OH的变化的曲线是b.
(2)用H2表示从0~2s内该反应的平均速率v(H2)=0.006mol•L-1•s-1.
(3)能说明该反应已达到平衡状态的是b c.
a.v(CH3OH)=2v(H2) b.容器内压强保持不变
c.2v逆(CO)=v正(H2) d.容器内密度保持不变
(4)已知常温常压下1g液态甲醇燃烧生成CO2气体和液态水放出22.68kJ的热量,则该反应的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.76kJ•mol-1.
(5)CH3OH与O2的反应可将化学能转化为电能,其工作原理如图2所示,图中CH3OH从A(填A或B)通入,b极的电极反应式是O2+4e-+2H2O=4OH-.
 近年来甲醇用途日益广泛,越来越引起商家的关注,工业上甲醇的合成途径多种多样.现有实验室中模拟甲醇合成反应,在2L密闭容器内,400℃时反应:CO(g)+2H2(g)?CH3OH(g)△H<0,体系中n(CO)随时间的变化如表:
近年来甲醇用途日益广泛,越来越引起商家的关注,工业上甲醇的合成途径多种多样.现有实验室中模拟甲醇合成反应,在2L密闭容器内,400℃时反应:CO(g)+2H2(g)?CH3OH(g)△H<0,体系中n(CO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 5 |
| n(CO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |
(2)用H2表示从0~2s内该反应的平均速率v(H2)=0.006mol•L-1•s-1.
(3)能说明该反应已达到平衡状态的是b c.
a.v(CH3OH)=2v(H2) b.容器内压强保持不变
c.2v逆(CO)=v正(H2) d.容器内密度保持不变
(4)已知常温常压下1g液态甲醇燃烧生成CO2气体和液态水放出22.68kJ的热量,则该反应的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.76kJ•mol-1.
(5)CH3OH与O2的反应可将化学能转化为电能,其工作原理如图2所示,图中CH3OH从A(填A或B)通入,b极的电极反应式是O2+4e-+2H2O=4OH-.
6.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 1 mol CH5+(碳正离子)中含有的电子数为11NA | |
| B. | 6.8g熔融的KHSO4中含有0.1NA个阳离子 | |
| C. | 质量相等、密度不等的N2和C2H4两种气体所含的分子数均为NA | |
| D. | 室温下,42.0g乙烯和丙烯的混合气体中含有的碳原子数为3NA |
10.下列对一些实验事实的理论解释正确的是( )
| 选项 | 实验事实 | 理论解释 |
| A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
| B | CO2为直线形分子 | CO2分子中C=O之间的夹角为109°28′ |
| C | 金刚石的熔点低于石墨 | 金刚石是分子晶体,石墨是原子晶体 |
| D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
| A. | A | B. | B | C. | C | D. | D |
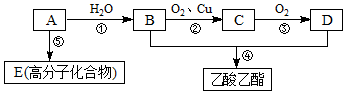
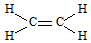 .
.