题目内容
18.下列叙述中正确的说法有( )种①两种原子构成的共价化合物分子中的化学键都是极性键
②两种不同非金属元素原子间形成的化学键都是极性键
③含有非极性键的化合物一定是共价化合物
④难失去电子的原子,易形成阴离子
⑤构成单质分子的微粒一定含有共价键
⑥非极性键只存在于双原子单质分子中
⑦一块冰中氢氧原子间只以化学键相结合.
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
分析 ①两种原子构成的共价化合物,一定为不同元素的原子,如H-O-O-H;
②两种不同非金属元素原子间形成的化学键一定有电子的偏移;
③含有非极性键的化合物,可能为离子化合物;
④难失去电子的原子,可能也难得到电子;
⑤构成单质分子的微粒中可能不含化学键;
⑥非极性键可存在于非金属单质、共价化合物、离子化合物中;
⑦冰中含共价键、氢键、分子间作用力.
解答 解:①两种原子构成的共价化合物,一定为不同元素的原子,如H-O-O-H中含极性键和非极性键,故错误;
②两种不同非金属元素原子间形成的化学键一定有电子的偏移,则一定为极性键,故正确;
③含有非极性键的化合物,可能为离子化合物,如过氧化钠中含O-O非极性键,故错误;
④难失去电子的原子,可能也难得到电子,如稀有气体,故错误;
⑤构成单质分子的微粒中可能不含化学键,如稀有气体分子,故错误;
⑥非极性键可存在于非金属单质、共价化合物、离子化合物中,如过氧化钠中含O-O非极性键,H-O-O-H中含非极性键,故错误;
⑦冰中含共价键、氢键、分子间作用力,冰中氢氧原子间除共价键外还存在氢键,故错误;
故选A.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度不大.

练习册系列答案
相关题目
8.下列说法中正确的是( )
| A. | 元素的种类由原子的质量数决定 | |
| B. | HF、HCl、HBr、HI的还原性从左到右依次减弱 | |
| C. | 第三周期非金属元素所形成的所有含氧酸的酸性从左到右一定依次增强 | |
| D. | 元素周期律是元素原子核外电子排布周期性变化的结果 |
9.既有离子键,又有共价键的化合物是( )
| A. | KBr | B. | NaOH | C. | HBr | D. | N2 |
13.除去下列杂质(括号中为杂质),采用的试剂和除杂方法错误的是( )
| 选项 | 含杂质的物质 | 试剂 | 除杂方法 |
| A | C2H4(SO2) | 溴水 | 洗气 |
| B | C6H6(Br2) | NaOH溶液 | 分液 |
| C | C6H5NO2(HNO3) | NaOH溶液 | 分液 |
| D | C2H2(H2S) | CuSO4溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
10.若用X、Y、Z和R分别代表四种元素,而且aXm+、bYn+、cZn-、dRm-四种离子的电子层结构都与S2-相同,则下列关系式正确的是( )
| A. | a-b=m-n | B. | b-d=m-n | C. | c-n=18 | D. | a-m=16 |
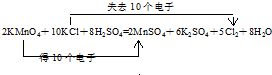 .
.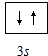
 ,氯原子核外有17不同运动状态的电子.
,氯原子核外有17不同运动状态的电子.



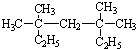 系统命名为3,3,5,5-四甲基庚烷;
系统命名为3,3,5,5-四甲基庚烷; ,B
,B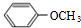 ,C
,C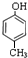 .
.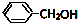 四种有机物能氧化成醛的是AD; 能消去成烯的是BC;
四种有机物能氧化成醛的是AD; 能消去成烯的是BC; 、
、 .
.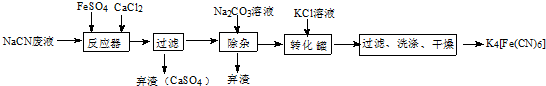
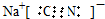 ;实验室用NaCN固体配制NaCN溶液时,应先将其溶于NaOH溶液,再用蒸馏水稀释.
;实验室用NaCN固体配制NaCN溶液时,应先将其溶于NaOH溶液,再用蒸馏水稀释.